© У.Ю.Руженцова, О.Н.Гуткина, А.В.Густов, 2002 г.
УДК 616.13
Поступила 2.08.2002 г.
У.Ю.Руженцова, О.Н.Гуткина, А.В.Густов
Государственная медицинская академия, Нижний Новгород
Характеристика сегментарной вегетативной регуляции при артериальной гипертонии
Среди пациентов, страдающих артериальной гипертонией (АГ), выделяют группу больных, у которых наблюдается выраженный синдром вегетативных дисфункций. Эти лица составляют около 30% от всех больных АГ [1].
В патогенезе АГ имеют место вегетативные нарушения 2, локализующиеся как на надсегментарном, так и на сегментарном уровнях.
На поражение лимбико-ретикулярного комплекса у больных АГ указывают тревожно-депрессивные расстройства на ранних стадиях заболевания, которые имеют большое значение в развитии гипертензивных реакций, таких как гипертонические кризы, транзиторные подъемы АД при панических атаках. Нарушения вегетативной регуляции, возникающие на уровне лимбико-ретикулярного комплекса, находят реализацию на периферии через посредство сегментарного уровня вегетативной нервной системы 3, 4.
Сегментарный уровень вегетативной нервной системы состоит из симпатического и парасимпатического отделов, для каждого из которых характерны четкие закономерные детерминированные проявления. Основу сегментарных вегетативных нарушений составляют процессы раздражения или выпадения (нередко их сочетание) периферических вегетативных нейронов, расположенных в стволе головного мозга, спинном мозге, вегетативных узлах и их аксонах. Вегетативные нарушения сегментарного характера связаны с механизмом денервации, потери контроля вегетативной нервной системы за деятельностью висцеральных органов, сосудов, гладкой мускулатуры. Особенностью сегментарных вегетативных дисфункций является топическая детерминированность, хорошая соотнесенность между вовлеченными в патологический процесс вегетативными образованиями и патологическими проявлениями в иннервируемых ими тканях. При этом обнаруживаются снижение числа нейронов в боковых рогах спинного мозга, вегетативных ганглиях, исчезновение маломиелизированных и немиелизированных волокон 2,5.
Кроме того, определенное значение имеет и возрастное изменение вегетативной регуляции сердечно-сосудистой системы. При старении уменьшается общее количество адрено– и барорецепторов 6. Некоторыми авторами выдвинуто предположение, что в патогенезе АГ имеет место и перестройка функционального состояния адрено– и барорецепторов, что вызывает повышение сосудистой реактивности, АД, после чего происходят морфологические изменения стенок сосудов как проявление адаптационной перестройки в связи с увеличенным напряжением стенки 6,7.
При АГ отмечаются явные признаки недостаточного сегментарного парасимпатического и симпатического контроля синусового ритма с повышением роли центральных симпатикоадреналовых влияний. Наличие нарушенной регуляции синусового ритма означает отсутствие возможности приводить в соответствие друг с другом периферическое сопротивление и сердечный выброс, что является одним из механизмов неадекватных изменений АД. Соответственно патологические и даже физиологические процессы в высших отделах головного мозга, влияя на состояние сердечного выброса и, возможно, периферического сопротивления, в условиях ослабленного барорефлекторного контроля могут вызывать патологические изменения АД 8.
Если в целом роль вегетативной нервной системы при АГ не вызывает сомнений, то патогенетическое значение сегментарного (периферического) отдела остается неясным. Работы, посвященные изучению состояния сегментарного отдела при АГ, единичны.
Цель работы — изучить функциональное состояние сегментарного (периферического) отдела вегетативной нервной системы, степень выраженности и форму периферической вегетативной недостаточности (ПВН) у больных АГ в сравнении с показателями у практически здоровых людей.
Материалы и методы.
Это исследование — контролируемое, рандомизированное, принцип рандомизации — АВС. При включении в группу больного исследования проводились согласно следующему дизайну:
Критерии включения были следующие: впервые выявленная и ранее установленная АГ, мягкой и умеренной формы 1-й и 2-й стадии.
Критерии исключения — сахарный диабет, злоупотребление алкоголем.
Группу больных АГ составили 36 женщин и 51 мужчина в возрасте от 32 до 70 лет (средний возраст 54±3,9 года). Давность заболевания составляла от 2 до 25 лет. Большинство больных имели два или три основных фактора риска АГ (генетическая предрасположенность, гиперхолестеринемия, курение и др.). У 31 человека отмечена АГ 1-й степени, у 56 человек — 2-й степени (по классификации ВОЗ/МОАГ, 1999). Диагноз АГ устанавливался после исключения симптоматической АГ с помощью лабораторных и инструментальных методов исследования.
В контрольную группу вошли 15 практически здоровых людей (средний возраст 23,2±2,1 года).
Состояние периферических вегетативных волокон у 87 больных АГ оценивалось с помощью вегетативного кардиоваскулярного тестирования 2, 9, 10. Его преимущества — неинвазивность, надежность, информативность, небольшие затраты времени. Использование кардиоваскулярных тестов позволяет выявить раннее, субклиническое поражение вегетативных нервных волокон 9.
Использовались пять функциональных тестов:
1. Определение различий между максимальным и минимальным значением кардиоинтервалов R—R при глубоком медленном дыхании (6 в минуту) — К6д.
2. Измерение интервалов R—R (15-го и 30-го) при ЧСС с момента начала вставания при ортопробе, вычисление индекса 30:15 — К30:15.
3. Проба Вальсальвы: дыхание в мундштук, соединенный с манометром, поддержание давления в спирометре на уровне 40 мм рт. ст. в течение 10—15 с; вычисление коэффициента Вальсальвы: отношение удлиненного интервала R—R в первые 20 с после пробы к укороченному R—R во время пробы (КВальс).
4. Определение изменений систолического АД при ортопробе: в положении лежа и на 3-й минуте в положении стоя (DАДС).
5. Проба с изометрическим напряжением: сжимание динамометра силой 30% от максимальной в течение 3 мин, определение изменений диастолического АД до пробы и на 3-й минуте сжимания динамометра (DДАД).
Первые три теста направлены на исследование эфферентных парасимпатических путей (ЧСС-тесты), два других — на исследование эфферентных симпатических путей (АД-тесты). Количественные данные, используемые для оценки результатов тестов, приведены в табл. 1.
Таблица 1
Оценка вегетативных тестов |
 |
Для суммарной оценки вегетативного статуса использовалась классификация вегетативной невропатии по степени тяжести D. Ewing (1985) 11, 12:
Норма (нет поражения): результаты всех пяти тестов — отрицательные или результаты одного теста — пограничные.
Начальное поражение: результаты одного из трех ЧСС-тестов — положительные или результаты двух тестов — пограничные.
Несомненное поражение: результаты двух или более ЧСС-тестов — положительные.
Грубое поражение: положительные результаты двух или более ЧСС-тестов плюс положительные результаты одного или двух АД-тестов или пограничные результаты обоих АД-тестов.
Атипичный вариант: любая другая комбинация положительных результатов тестов.
Для оценки состояния периферических симпатических волокон 30 больным АГ 1-й и 2-й стадии проводилось также исследование вызванных кожных симпатических потенциалов (ВКСП). Этот метод позволяет количественно оценить состояние эфферентных симпатических потоотделительных волокон 13, 14. Исследование проводилось на электронейромиографе NMB (Россия) — автоматизированной системе анализа биопотенциалов с возможностью распечатки результатов и визуализации данных на экране дисплея. Методика основана на регистрации кожно-гальванических ответов при действии электрического стимула. В качестве электрического стимула использовались одиночные нерегулярные импульсы прямоугольной формы, длительностью 0,1 с. Стимулы подавались в случайном порядке с интервалом не менее 20 с после угасания спонтанных кожно-гальванических рефлексов. 4 кожно-гальванических ответа усредняются и обозначаются как вызванный кожный симпатический потенциал.
Формирование ВКСП проводилось с помощью стандартных поверхностных хлорсеребряных электродов размером 15325 мм. На кисти катод располагался во втором межкостном промежутке на ладонной поверхности, на 3 см проксимальнее межпальцевых промежутков, а анод — на подушечке левого среднего пальца. Заземляющая пластинка укреплялась на левом запястье. На стопе катод прикреплялся ко второму межпальцевому промежутку, анод — к подушечке 2-го пальца, заземляющий электрод — в области нижней трети голени.
Предполагается, что изменение напряжения при ВКСП обусловлено синхронизированной активацией ладонных и подошвенных эккринных потовых желез, контролируемых симпатической вегетативной нервной системой. В формировании ВКСП принимают участие задний гипоталамус, ретикулярная формация. В нашем исследовании определялись латентные периоды (ЛП ВКСП ) и их амплитуды (А ВКСП). Поскольку афферентные преганглионарные волокна являются миелинизированными и быстропроводящими, ЛП ВКСП отражает в основном проводимость по немиелинизированным постганглионарным волокнам и время нейроэффекторной передачи 15.
У здоровых людей ВКСП (М±m) представляют собой двухфазные колебания потенциалов с латентностью 2000±0,2 мс для ладони и 2004±0,17 мс для стопы. Амплитуда ВКСП ладони и стопы у них составляет соответственно 330±102 и 230±81,7 мкВ 16, 17.
Для статистической обработки результатов исследования использовалась программа «Stadia».
Результаты исследования. Полученные результаты статистического и графического анализов кардиоваскулярного тестирования позволили выявить нарушение периферического отдела вегетативной нервной системы (ПВНС) у больных АГ.
У 48,2% больных АГ установлено несомненное поражение, у 36,7% — начальное поражение, у 4,8% — грубое поражение ПВНС (табл. 2). У 10,3% больных зарегистрирована нормальная функция периферической вегетативной нервной системы.
Таблица 2
Степень выраженности ПВН по результатам кардиоваскулярного тестирования у больных АГ и в контрольной группе |
 |
В контрольной группе практически здоровых у 12,7% регистрировалось начальное поражение сегментарного уровня вегетативной нервной системы. У 87,3% исследуемых выявлена нормальная функция ПВНС.
Сравнительная характеристика состояния ПВНС в группе больных АГ и у здоровых показана на рис. 1.
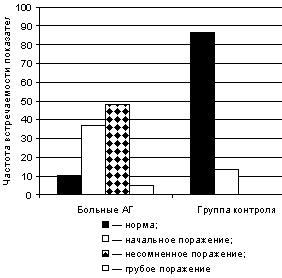 |
| Рис. 1. Степень выраженности ПВН по результатам кардиоваскулярного тестирования у больных АГ и в контрольной группе |
Клиническая картина у больных АГ с несомненными и грубыми нарушениями ПВНС — полисистемна, неспецифична и имела свои особенности. У 56,7% больных заболевание характеризовалось кризовым течением. Выявлялись следующие жалобы: беспокойство, страх (21,4%), потливость (83,4%), чувство легкой дрожи, головная боль (88,7%), тахикардия в покое (48,6%), боли в области сердца (29,8%), временные нарушения зрения — потемнение в глазах, мушки перед глазами (5,8%), головокружение, общая слабость при проведении ортостатической пробы (28,9%), тошнота (17,2%), импотенция (7,2%). При назначении гипотензивной терапии у больных АГ с выраженными вегетативными дисфункциями в 39,9% случаев регистрировался эффект первой дозы. У 17% больных отмечалось бессимптомное течение заболевания. Больные АГ с бессимптомным течением — группа риска по сердечно-сосудистым осложнениям (инфаркт миокарда, инсульт), так как у этой группы пациентов адекватную гипотензивную терапию проводить труднее.
Приведем пример.
Больной К., 45 лет. Поступил в октябре 2001 г. в терапевтическое отделение городской клинической больницы №33 с диагнозом: «артериальная гипертония 2-й степени. Неосложненная форма. Риск 2 (дислипидемия, отягощенная наследственность, курение)».
При поступлении беспокоили общая слабость, снижение работоспособности, нарушение мочеиспускания. Обращали на себя внимание кратковременные подъемы АД до 200/130 мм рт.ст. — от нескольких раз в неделю до нескольких раз в сутки..
Из анамнеза заболевания: диагноз АГ впервые поставлен год назад в районной поликлинике (АД — 180/120 мм рт. ст.). Рекомендованную лекарственную терапию не проводил. Появление вышеописанных жалоб и ухудшение общего самочувствия привели к необходимости полного обследования и коррекции АД в клинических условиях.
Патогенетические факторы из анамнеза жизни: отягощенная наследственность по АГ, курение.
При объективном осмотре установлено: гиперстеническая конституция, увеличение левых отделов сердца. Тоны сердца — приглушены, ритмичные, акцент 2-го тона над аортой, систолический шум в области верхушки. ЧСС — 84 удара в минуту. АД при поступлении 160/100 мм рт. ст. Пульсация на артериях тыла стопы — удовлетворительная.
Общеклинические анализы: гиперхолестеринемия, дислипидемия.
ЭКГ: ритм — синусовый, регулярный, умеренные изменения миокарда левого желудочка (снижение зубца Т в отведениях V4–6, V1, aVL, aVF).
Суточное мониторирование АД: устойчивая систолодиастолическая артериальная гипертензия в пределах 160/100 мм рт. ст. — 2-я степень гипертензии. Суточный ритм нарушений — больной «non-dipper». Вариабельность АД повышена. Коррелляция с режимом физической активности — отчетливая. Показатели утреннего подъема АД повышены.
Проба с реактивной гиперемией: снижение DОСК (%) — 28% через 15 с после декомпрессии манжетки, что свидетельствует об эндотелиальной дисфункции.
Кардиоваскулярное тестирование: положительный ЧСС-тест, что свидетельствует о начальном поражении периферической вегетативной нервной системы (по классификации вегетативной невропатии по Эвингу).
Вызванный кожный симпатический потенциал: невропатия по аксональному типу симпатической порции большеберцовых нервов с двух сторон, признаки вегетативной полиневропатии с ног по аксональному типу.
При терапии использовалась общепринятая тактика ведения пациентов АГ с помощью следующих препаратов: энап, кордалекс, гипотиазид, реополиглюкин, седативные препараты. Положительный терапевтический эффект был достигнут в течение 2,5 нед.
У 44,8% больных АГ отмечено поражение периферического отдела симпатической нервной системы, у 27,6% — периферического отдела парасимпатической вегетативной нервной системы, у 17,3% регистрируется смешанная форма поражения (табл. 3). На рис. 2 показана сравнительная характеристика формы ПВН у больных АГ и в контрольной группе.
Таблица 3
Форма ПВН по результатам кардиоваскулярного тестирования у больных АГ и в контрольной группе |
 |
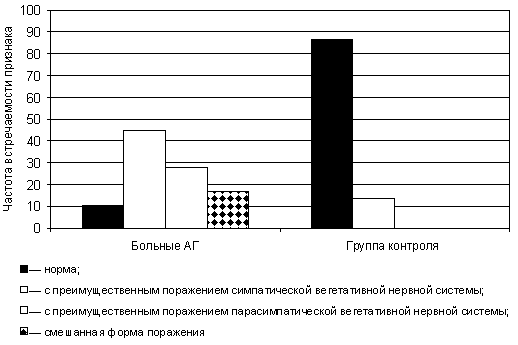 |
| Рис. 2. Форма ПВН у больных АГ и в контрольной группе |
Результаты статистического анализа ВКСП также позволили выявить нарушение ПВНС у больных АГ (табл. 4).
Таблица 4
Сравнительная характеристика показателей ВКСП (латентный период ВКСП ) у больных АГ и в контрольной группе (M±m) |
 |
| * р< 0,05 в сравнении со здоровыми. |
Сравнительная характеристика показателей ВКСП в группе больных АГ и группе контроля показана на рис. 3.
 |
| Рис. 3. Сравнительная характеристика показателей ВКСП у больных АГ и в контрольной группе: а — ЛП ВКСП; б — А ВКСП |
Данные табл. 4 и рис. 3 демонстрируют, что в группе больных АГ при исследовании ВКСП с симпатической порции срединных и большеберцовых нервов при стимуляции моторной порции правого срединного и малоберцового нерва с двух сторон регистрируются статистически достоверное удлинение ЛП ВКСП и снижение А ВКСП, что, по данным литературы, свидетельствует о поражении ПВНС 14, 16.
При стимуляции срединных нервов левой и правой рук ЛП ВКСП составляет с симпатической порции срединных нервов 2334±49 и 2255±58 мс соответственно. Показатели ЛП ВКСП с симпатической порции большеберцовых нервов при стимуляции малоберцовых нервов левой и правой ног — 2923±51,5 и 2946±68 мс соответственно.
В группе больных АГ выявляется также уменьшение А ВКСП. При стимуляции срединных нервов левой и правой рук ее значение с симпатической порции срединных нервов составляет 120,9±13,8 и 128,8±12,6 мкВ соответственно, при стимуляции малоберцовых нервов левой и правой ног ее значение с симпатической порции большеберцовых нервов — 85,25±4,5 мкВ и 99±3,7 мкВ соответственно. Обсуждение. АГ — заболевание, клиническое течение и тяжесть которого зависят от патогенетических механизмов повышения АД. Одним из таких механизмов являются нарушения, возникающие на надсегментарном и сегментарном уровнях вегетативной нервной системы.
Результаты исследований ВКСП показали, что при АГ регистрируется поражение сегментарного отдела вегетативной нервной системы. При кардиоваскулярном тестировании у 89,7% больных АГ выявлено как субклиническое, так и клиническое поражение ПВНС, преимущественно симпатического отдела.
При регистрации ВКСП у больных АГ отмечается удлинение ЛП ВКСП и уменьшение А ВКСП, что свидетельствует о диффузном умеренном поражении периферических симпатических волокон.
Мы предполагаем, что генез периферической полиневропатии при АГ связан с поражением vasa nervorum, т.е. с выраженностью эндотелиальной дисфункции 18, которая является также одним из патогенетических механизмов повышения АД.
Заключение.
Вегетативное кардиоваскулярное тестирование у 89,7% больных АГ выявило поражение ПВНС. При несомненных и грубых нарушениях ПВНС установлены особенности клинического течения АГ.
При исследовании у них ВКСП выявлено статистически достоверное по сравнению с контрольной группой удлинение ЛП ВКСП и уменьшение А ВКСП, что доказывает поражение периферических вегетативных волокон при АГ.
Таким образом, исследование состояния сегментарного отдела вегетативной нервной системы — один из путей совершенствования гипотензивной терапии.
Литература
Николаев К.Ю., Куроедов А.Ю., Лифшиц Г.И. Вариант эссенциальной артериальной гипертензии с выраженной симптоматикой вегетативных дисфункций. Артериальная гипертензия 2000; 6(1): 55—57.
Вегетативные расстройства: Клиника, лечение, диагностика. Под ред. А.М. Вейна. М: Медицинское информационное агентство; 2000.
Watkins L.L., Grossman P., Krishnan R. Psychosom Med 1999; 61(3): 334—407.
Watkins L.L., Grossman P., Krishnan R. Psychosom Med 1998; 60(4): P. 498—502.
Pfaffenrath V., Gerber W.D. Chronische Kopfscmerzen. Stuttgart, Berlin, Koln, 1992.
Храмов Ю.А., Вебер В.Р. Вегетативное обеспечение и гемодинамика при гипертонической болезни. Новосибирск; 1985; с. 58—64.
Bockman C., Jefries W., Pettinger W. Hypertension 1992; 20: 304—313.
Недоступ А.В., Федорова В.И., Дмитриев К.В. Лабильная артериальная гипертония, клинические проявления, состояние вегетативной регуляции кровообращения, подходы к лечению. Клиническая медицина 2000; 7: 27—31.
Данилов А.Б. Периферическая вегетативная недостаточность. Журнал невропатологии и психиатрии им. С.С. Корсакова 1997; 12: 44—50.
Аршин Е.В. Сегментарный отдел вегетативной нервной системы у больных гипертонической болезнью. В кн. :Материалы Всероссийского съезда неврологов; с. 438.
Mathias C.J. Role of sympathetic efferent nerves in blood pressure regulation and in hypertension. Hypertension 1991; 18: 22—30.
Данилов А.Б., Алимова Е.Я., Голубев В.Л. Периферическая вегетативная недостаточность. Журнал невропатологии и психиатрии им. С.С. Корсакова 1988; 88(10): 121—128.
Вейн А.М., Данилов А.Б. Диагностическое значение вызванных кожных симпатических потенциалов. Журнал невропатологии и психиатрии им. С.С. Корсакова 1992; 92(5): 3—7.
Одинак М.М. Топическая диагностика заболеваний и травм нервной системы. СПб,1997; с. 195—197. Elie B., Guihenc P. Electroenceph Clin Neurophysiolog 1990; 76(3): 258—267.
Данилов А.Б., Окнин В.Ю. Электрофизиологический анализ функции потоотделительных волокон при различных заболеваниях. Журнал невропатологии и психиатрии им. С.С.Корсакова 1998; 98(5): 25—27.
Михайленко А.А., Одинак М.М., Иванов Ю.С. Журнал невропатологии и психиатрии им. С.С. Корсакова 1997; 97(4): 58—61.
Гуткина О.Н., Руженцова У.Ю., Гальперин Е.В. Периферическая вегетативная регуляция сосудодвигательной функции эндотелия у больных эссенциальной гипертонией. Нижегородский медицинский журнал 2001; 4: 10—15.

