© К.В. Дмитренко, 2002 г.
УДК 616.517:615.7
Поступила 5.06.2002 г.
К.В. Дмитренко
Научно-исследовательский кожно-венерологический институт МЗ РФ, Нижний Новгород
Псориаз и иммуноактивные препараты
Роль клеток и медиаторов иммунной системы в патогенезе псориаза в настоящее время не вызывает сомнений, причем многие исследователи признают ее ведущей. Описаны различные нарушения иммунного статуса у больных псориазом: дисбалансы субпопуляций лимфоцитов, повышенная выработка аутоантител к дермальным антигенам, функциональная недостаточность различных звеньев иммунитета [1—4], причем нередко данные различных исследователей оказываются противоречивыми. Это обусловлено, по-видимому, различиями как в методических подходах, так и в интерпретации полученных данных.
В последние годы стала популярной концепция об инициации патологической пролиферации эпидермиса при псориазе активированными Т-хелперами 1-го типа (Th1), инфильтрирующими кожу 5—11. Будучи активированы, эти клетки наряду с клетками моноцитарно-макрофагальной системы и кератиноцитами вырабатывают большое количество провоспалительных цитокинов, таких как интерлейкины (ИЛ-1, ИЛ-2, ИЛ-6, ИЛ-8, ИЛ-12), фактор некроза опухоли (ФНОa), гамма-интерферон (ИНФg) 12—22, что вызывает гиперпролиферацию и нарушение дифференцировки кератиноцитов 23—27. Стимулированные кератиноциты, в свою очередь, выделяют цитокины, поддерживающие активированное состояние Т-клеток, замыкая порочный круг и способствуя длительной персистенции псориатических очагов 28—29.
Такие взгляды на патогенез заболевания объясняют эффективность традиционно применяемых при псориазе различных цитостатических воздействий, таких как ультрафиолетовое облучение (УФO) во всех вариациях, использование метотрексата, циклоспорина А, ретиноидов, глюкокортикоидов и др. 30. В отечественной клинической практике также широко используются так называемые иммуномодуляторы — препараты, назначаемые с целью коррекции нарушений иммунного статуса. Многие авторы отмечают положительный эффект от применения в качестве иммунокорректоров при псориазе таких препаратов, как пирогенал, продигиозан, левамизол, ликопид, циклоферон, неовир, имунофан, препаратов тимуса и др. 31—33.
При назначении того или иного препарата авторы руководствуются тем положением, что иммуномодулятор должен нормализовать иммунный статус, стимулируя его ослабленные звенья и угнетая излишне активированные, разрабатывают принципы индивидуального подхода при выборе иммуномодулирующих средств в зависимости от характера выявленных нарушений иммунограммы 34.
Как в отечественной, так и в зарубежной литературе имеются описания и случаев обострения псориаза под влиянием различных стимуляторов иммунной системы, появления заболевания de novo 6, 35, 36.
Цель исследования — сравнительная оценка эффективности различных методов иммунотерапии псориаза.
Материал и методы.
Для оценки эффективности различных методов иммунотерапии исследовано течение псориаза у больных, получавших современные иммуноактивные препараты полиоксидоний и миелопид, а также пентоксифиллин. Последний применялся ранее в качестве вазодилататора. Основанием для назначения пентоксифиллина в качестве иммунокорректора послужило выявление его способности угнетать in vitro выработку клетками-продуцентами провоспалительного цитокина ФНОa 37.
Все препараты назначались на фоне традиционной терапии, включавшей гипосенсибилизирующие средства, витамины, мазевое лечение, по показаниям — УФО и метотрексат по общепринятым схемам.
Все пациенты были случайным образом разделены на 4 группы.
Первая группа состояла из 24 больных распространенным псориазом (16 мужчин и 8 женщин). Средний возраст пациентов — 44 года, среднее значение индекса тяжести и распространенности псориаза (PASI) до лечения — 10,9 балла. Больные этой группы получали полиоксидоний по 6 мг внутримышечно через день по 5 инъекций.
Во вторую группу вошли 10 аналогичных пациентов (по 5 мужчин и женщин). Средний возраст — 44 года, среднее значение индекса PASI до лечения — 9,8 балла. В этой группе использовали миелопид по 3 мг внутримышечно через день по 10 инъекций.
Третью группу составили 50 больных псориазом (36 мужчин и 14 женщин). Средний возраст — 38 лет, среднее значение индекса PASI до лечения — 12,1 балла. Больным назначали пентоксифиллин внутрь по 200 мг 3 раза в сутки ежедневно в течение 20 дней.
Четвертая группа — контрольная, состояла также из 50 пациентов (33 мужчины и 17 женщин). Средний возраст — 39 лет, среднегрупповое значение индекса PASI до лечения — 11,7 балла. Эти больные получали традиционную терапию.
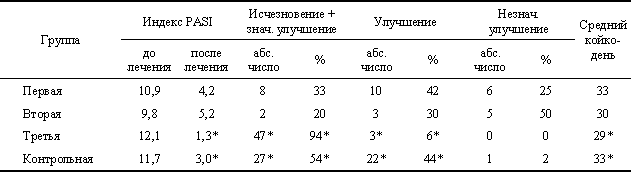
У всех пациентов до и после лечения оценивали тяжесть заболевания с использованием индекса PASI, снижение которого на 75— 99% трактовали как значительное улучшение, на 50—74% — как улучшение, на 25—49% — как незначительное улучшение (табл. 1) Наряду с общеклиническим и рутинным биохимическим обследованием у всех пациентов изучали иммунный статус в динамике.
Таблица 1
Результаты лечения больных псориазом (по индексу PASI) |
 |
| * р < 0,05 |
Содержание лимфоцитов и их субпопуляций в крови определяли с использованием моноклональных антител, иммуноглобулинов — методом радиальной диффузии по Манчини.
В связи с тем, что распределение значений изучаемых показателей заметно отличалось от нормального, для статистической обработки данных мы воспользовались непараметрическими критериями. Так, для оценки динамики индекса PASI был использован критерий Даннета; доли больных с положительным результатом лечения (исчезновение клинических проявлений либо значительное улучшение) в группах сравнивали, оценивая критерий z с поправкой Йейтса.
Расчеты производились при помощи программного пакета «Анализ данных» и встроенных функций электронных таблиц «Microsoft Excel».
Результаты и обсуждение.
Динамика основных лабораторных показателей, отражающих состояние иммунной системы пациентов, представлена в табл. 2 и 3.
Таблица 2
Среднее содержание лимфоцитов у больных псориазом, млрд./л* |
 |
| * Для всех показателей до и после лечения р>0,05. |
Таблица 3
Среднее содержание иммуноглобулинов основных классов в крови больных псориазом, г/л * |
 |
| * Для всех показателей до и после лечения р > 0,05. |
В исследованных группах, сопоставимых по соотношению полов и возрасту, не выявлено статистически значимых различий среди больных по тяжести заболевания на основании индекса PASI до лечения.
Пациенты перенесли лечение хорошо. Каких-либо побочных действий примененных препаратов не было отмечено за исключением одного случая тошноты, совпавшей по времени с назначением пентоксифиллина и регрессировавшей после его отмены.
Анализ клинических данных показал, что в третьей группе доля пациентов, выписанных с исчезновением проявлений дерматоза либо значительным улучшением, оказалась достоверно выше по сравнению с контролем. Это сопровождалось снижением среднего значения индекса PASI в процессе лечения в 9,3 раза, в то время как в первой, второй и четвертой — в 2,6, 1,9 и 3,9 раза соответственно (p <0,05). Статистически значимых различий в эффективности лечения первой, второй и четвертой групп выявить не удалось, хотя обращала на себя внимание тенденция к худшей динамике индекса pasi в первой и второй группах по сравнению с контрольной. Длительность пребывания в стационаре больных разных групп существенно не различалась. Абсолютное содержание в крови пациентов лимфоцитов разных субпопуляций и иммуноглобулинов классов g, m и a также не претерпело в процессе лечения заметных изменений.
Заключение.
Таким образом, наибольшая эффективность лечения по сравнению с контролем отмечалась в группе больных псориазом, получавших в составе комплексной терапии пентоксифиллин. Напротив, как миелопид, так и полиоксидоний не оказали какого-либо положительного влияния ни на клинические проявления дерматоза, ни на исследованные иммунологические показатели. Этот факт позволяет поставить вопрос о целесообразности назначения различных иммуноактивных препаратов больным псориазом в надежде на их модулирующее действие. Мы убеждены, что патогенетически более обосновано целенаправленное угнетение звеньев иммунной системы, имеющих непосредственное отношение к регуляции пролиферации эпидермиса. Это подтверждает и первый успешный опыт применения пентоксифиллина в качестве иммунокорректора в лечении больных псориазом.
Литература
Скрипкин Ю.К. Кожные и венерические болезни. Руководство для врачей. М: Медицина; 1995; 2: 181—184.
Мордовцев В.Н., Мушет Г.В., Альбанова В.И. Псориаз. Кишинев; 1991: 121—128.
Довжанский С.И. Псориаз. Саратов; 1976: 119—126.
Левин М.М., Левин М.Я., Чернышев И.С. и др. Показатели состояния иммунитета у больных псориазом. Вестн дерматол 1996; 5: 20—23.
Вавилов А.М., Самсонов В.А., Димант Л.Е., Завалишина Л.Э. Иммуноморфологические исследования Т-лимфоцитов в коже у больных псориазом. Вестн дерматол 2000; 4: 4—5.
Мазина Н.М., Парастаев С.А., Москаленко М.Б. Иммунологические исследования в дерматологии. Вестн дерматол 1991; 7: 33—37.
Василевский С.С. Взаимоотношение иммунологических и неиммунологических факторов патогенеза псориаза. Вестн дерматол 1990; 9: 26—29.
Valdimarsson H., Sigmundsdoffir H., Jonsdoffir I. Is psoriasis induced by streptococcal superantigens and maintained by M-protein-specific T-cells that cross-react vith ceratin? Clin Exp Immunol 1997; 107(1): 21—24.
Wrone-Smith T., Nickoloff B.J. Dermal injection of immunocytes induses psoriasis. J Clin Invest 1996; 98(8): 1695—1696.
Uyemura K., Yamamura M., Fivenson D.F. et al. The cytokine network in lesional and lesion-free psoriatic skin is characterized by a T-helper type 1 cell-mediated response. J Invest Dermatol 1993; 101 (5): 701—705.
Shlaak J.F., Buslau M., Jochum W. et al. T-cells involved in psoriasis vulgaris belong to the Th1 subset. J Invest Dermatol 1994; 102(2): 145—149.
Козин В.М., Адаменко Г.П., Богданович Л.И., Якиревич Е.В. Функциональные свойства интерлейкинов при псориазе. Вестн дерматол 1989; 7: 61—64.
Nishibu A., Han G.W., Iwatsuki K. et al. Overexpression of monocyte-derived cytokines in active psoriasis: a relation to coexistent arthropathy. J Dermatol Sci 1999; 21(1): 63—70.
Ameglio F., Bonifati C., Fazio M. et al. Interleukin-11 production is increased in organ cultures of lesional skin of patients with active plaque-type psoriasis as compared with nonlesional and normal skin. Similarity to interleukin-1 beta, interleukin-6 and interleukin-8. Arch Dermatol Res 1997; 289(7): 399—403.
Mizutani H., Ohmoto Y., Mizutani T. et al. Role of increased production of monocytes TNF-alpha, IL-1 beta and IL-6 in psoriasis: relation to focal infection, disease activity and responses to treatment. J Dermatol Sci 1997; 14(2): 145—153.
Scov L., Chan L.S., Fox D.A. et al. Lesional psoriatic T-cells contain the capacity to induce a T cell activation molecule Cdw60 on normal keratinocytes. Am J Pathol; 150(2): 675—683.
Teranishi Y., Mizutani H., Murata M. et al. Increased spontaneous production of IL-8 in peripheral blood monocytes from the psoriatic patient: relation to focal infection and response to treatment. J Dermatol Sci 1995; 10(1): 8—15.
Bonifati C., Carducci M., Cordiali-Fei P. et al. Correlated increases of tumor necrosis factor-alpha, interleukin-6 and granulocyte monocyte-colony stimulating factor levels in suction blister fluids and sera of psoriatic patients – relationships with disease severity. Clin Exp Dermatol; 19(5): 383—387.
Bonifati C., Ameglio F., Carducci M. et al. Interleukin-1 beta, interleukin-6 and interferon-gamma in succion blister fluids of involved and uninvolved skin and in sera of psoriatic patient. Acta Derm Venereol Suppl Stockh 1994; 186: 23—24.
Ohta Y., Nishiyama S., Nishioka K. In situ expression of interleukin-6 in psoriatic epidermis during treatment. J Dermatol 1994; 21(5): 301—307.
Yawalkar N., Karlen S., Hunger R. et al. Expression of interleukin-12 is increased in psoriatic skin. Invest Dermatol 1998; 111(6): 1053—1057.
Teunissen M.B., Koomen C.W., de Waal Malefyt R. et al. Interleukin-17 and interferon-gamma sinergize in the enhancement of proinflammatory cytokine production in human keratinocytes. J Invest Dermatol 1998; 111(4): 645—649.
Mizutani H., Ohmoto Y., Rupper T.S., Shimizu M. Endogenous neutralizing anti-IL-1 alpha autoantibodies in inflammatory skin diseases: possible natural inhibitor for over expressed interleukin-1. J Dermatol Sci 1998; 20(1): 63—71.
Wei L., Debets R., Hegmans J.J. et al. IL-1 beta and IFN-gamma induce the regenerative epidermal phenotype of psoriasis in the transwell skin organ culture system. IFN-gamma up-regulates the expression of keratin 17 and keratinocyte transglutaminase via endogenous IL-1 production. J Pathol 1999; 187(3): 358—364.
Hong K., Chu A., Ludviksson B.R. et al. IL-12, independently of IFN-gamma, plays a crutial role in the pathogenesis of a murine psoriasis-like skin disorder. J Immunol 1999; 162(12): 7480—7491.
Bata-Csorgo Z., Hammerberg C., Vorhees J.J., Cooper K.D. Kinetics and regulation of human keratinocyte stem cell growth in short-term primary ex vivo culture. Cooperative grouth factors from psoriatic lesional T-lymphocytes stimulate proliferation among psoriatic uninvolved, but not normal, stem keratinocytes. J Clin Invest 1995; 95(1): 317—327.
Baadsgaard O., Tong P., Elder J.T. et al. UM4D4+ (Cdw60) T cells are compartmentalized into psoriatic skin and release lymphokines that induce a keratinocyte phenotype expressed in psoriatic lesions. J Invest Dermatol 1990; 95(3): 275—282.
Elder J.T., Hammerberg C., Cooper K.D. Cyclosporine A rapidly inhibits epidermal cytokine expression in psoriasis lesions, but not in cytokine-stimulated cultured keratinocytes. J Invest Dermatol 1993; 101(6): 761—766.
Terui T., Ozawa M., Tagami H. Role of neutrophils in induction of acute inflammation in T-cell mediated immune dermatosis, psoriasis: a neutrophil-associated boosting loop. Exp Dermatol 2000; 182(3): 366—370.
Кубанова А..А., Самсонов В.А., Федоров С.М. и др. Опыт применения циклоспорина А — сандиммуна в терапии псориаза. Вестн дерматол 1994; 3: 18—19.
Скрипкин Ю.К., Каламкарян А.А., Мандель А.Ш., Тимошин Г.Г. Основные методы лечения больных псориазом. Вестн дерматол 1987; 7: 22—27.
Исаева М.П., Будажабон Г.Б., Кузник Б.И. Влияние тималина на показатели иммунитета и гемостаза у больных распространенными формами псориаза. Вестн дерматол 1989; 10: 42—43.
Бобиев Г.М., Зоиров П.Т., Хусейнов А.А. Применение нового иммуномодулирующего препарата тимогара при лечении псориаза и нейродермита. Иммунол 1999; 2: 46—49.
Гребенников В.А., Зотова В.В., Анисимова Л.А., Энгель М.Б. Сравнительная эффективность различных вариантов иммунокорригирующего лечения больных псориазом детей на основе кластерного анализа. Вестн дерматол 1994; 5: 26—29.
Wolfe J.T., Singh A., Lessin S.R. et al. De novo development of psoriatic plaques in patients receiving interferon alpha for treatment of erythrodermic cutaneous T-cell lymphoma. J Am Acad Dermatol 1995; 32(5pt2): 887—893.
Georgetson M.J., Jarze J.C., Lalos A.T. Exacerbation of psoriasis due to interferon-alpha treatment of chronic active hepatitis. Am J Gastroenterol 1993; 88(10): 1756—1758.
Фрейдлин И.С. Дефекты цитокиновой сети и принципы их коррекции. Иммунол 1998;6: 23—25.

