© В.В. Соколов, Б.Е. Шахов, Е.И. Матусова,
Е.В. Чеботарь, С.А. Востряков, М.В. Федорова,
Л.Н. Анцыгина, А.Л. Максимов, Д.Б. Котин
УДК 616.132—089
Поступила 28.11.2002 г.
В.В. Соколов, Б.Е. Шахов, Е.И. Матусова, Е.В. Чеботарь, С.А. Востряков, М.В. Федорова, Л.Н. Анцыгина, А.Л. Максимов, Д.Б. Котин
Областная специализированная клиническая кардиохирургическая больница, Нижний Новгород
Лечение больных ИБС до и после маммарокоронарного шунтированияи стентирования коронарных артерий
В Российской Федерации в структуре летальности смерть от сердечно-сосудистых заболеваний составляет 55,6%, и регресса этих данных не ожидается. Причинами являются образ жизни, низкий уровень профилактики, отсутствие четких протоколов лечения и, конечно, недостаточность кардиохирургической помощи населению. В настоящий момент выполняется 2,69 операции аортокоронарного шунтирования (АКШ) и 2,91 — коронарной баллонной ангиопластики (КБА) и стентирований на 100000 населения. Остается недостаточно отработанной подготовка больных ИБС к хирургическому и рентгенохирургическому лечению, не унифицировано ведение больных после вмешательств. Однако в деле улучшения подготовки к вмешательствам и оценки прогноза последующего течения заболевания в зарубежных и российских кардио-хирургических центрах накоплен большой опыт [1—6].
Медикаментозное лечение больных ИБС, подлежащих рентгено-хирургическому вмешательству — стентированию коронарных артерий или операции маммарокоронарного шунтирования (МКШ), — имеет общие черты, что обусловлено и общим анатомическим субстратом заболевания, и предметом хирургической агрессии — это гладкомышечные артерии небольшого диаметра.
В основе лечения должны лежать следующие принципы:
1. Непрерывность лечения до и после вмешательства.
2. Подготовка коронарного и артериального русла (внутренней грудной артерии) к вмешательству.
3. Обеспечение защиты подсудных артерий от хирургической агрессии.
Эти принципы реализуются обеспечением непрерывности подготовительной и интраоперационной терапии, созданием условий для максимально эффективного лечения в послеоперационном и в реабилитационном периодах.
С целью выполнения поставленных задач лечение должно вестись по следующим основным направлениям:
1) комбинированная антитромбоцитарная и антитромботическая терапия;
2) комбинированная вазодилатационная терапия;
3) обеспечение восстановления и сохранности эндотелиальной функции коронарных сосудов;
4) консолидация атероматозной бляшки и предотвращение местной воспалительной и вазоспастической реакции.
При проведении стентирования коронарных сосудов имеются факторы риска, зависящие как от особенностей самой процедуры (трудности имплантации стента, многососудистое стентирование, стентирование после реваскуляризации, дефекты антитромбоцитарной терапии), так и от особенностей организма пациентов (наличие нестабильности коронарного кровотока) и его коронарных сосудов (их размеры, бифуркационные поражения, стентирование аутовенозного шунта).
Своевременное предшествующее лечение существенно снижает риск осложнений. Лечение, начатое за 3 дня до хирургической агрессии, уменьшает число последующих коронарных событий (коронарной смерти, острого коронарного синдрома (ОКС), острого инфаркта миокарда (ОИМ), необходимости в АКШ) с 30 до 5%.
Комбинированная антитромбоцитарная и антитромботическая терапия
Эта терапия проводится с целью блокирования всех основных механизмов тромбообразования (рецепторов АДФ, тромбоксана А2, рецепторов глюкопротеинов IIб/IIIа, фактора фон Виллебранда, тромбина и т.д.) 7, 8.
Она включает использование следующих лекарственных средств.
Аспирин (ацетилсалициловая кислота) ингибирует циклооксигеназу-I и блокирует образование тромбоксана А2, т.е. подавляет агрегацию тромбоцитов, индуцируемую этим путем. Эффективная доза — 81—325 мг. Антитромбоцитарный эффект достигается в течение 30 мин. Блокируя тромбоксан А2, аспирин уменьшает также склонность артерий к спазму, вызываемую этим агентом. Имеет значение также противовоспалительное действие аспирина, играющее благоприятную роль при агрессивной тактике лечения ИБС. Препарат облигатно получают все больные с нестабильными формами ИБС и больные, готовящиеся к плановому стентированию коронарных артерий и не имеющие противопоказаний. Пациенты, которым предстоит МКШ, начинают прием аспирина только со вторых послеоперационных суток, так как его превентивное назначение повышает риск послеоперационных кровотечений.
Аспирин является наиболее распространенным антитромбоцитарным средством, но он обладает относительно слабым ингибирующим влиянием на тромбоциты, их адгезию и агрегацию, индуцированную аденозиндифосфатом (АДФ), тромбином и коллагеном.
Рекомендуемые его формы тромбо-АСС и аспирин-кардио назначают по 100 мг 1 раз в сутки на ночь.
Тиенопиридины — тиклопидин (тиклид) и клопидогрель (плавикс) — являются блокаторами активации тромбоцитов, индуцируемой АДФ, путем селективного и необратимого ингибирования связывания АДФ с рецептором на тромбоцитах. Тем самым предотвращается АДФ-зависимая активация комплекса гликопротеина IIб/IIIа, являющегося основным рецептором фибриногена на поверхности тромбоцитов. Тиенопиридины ингибируют также агрегацию тромбоцитов, обусловленную и другими факторами, такими как тромбин, коллаген, тромбоксан А2 и фактор активации тромбоцитов. Значительное количество побочных эффектов тиклида (нейтро– и тромбоцитопения, диарея, сыпь) и двукратный прием препарата по 250 мг в день заставляют отдать предпочтение клопидогрелю (плавиксу), лишенному большинства побочных эффектов и обладающему более высокой антитромбоцитарной активностью 2, 9, 10.
Поскольку у рассматриваемой группы пациентов агрессии подвергаются только артерии и речь идет, соответственно, об образовании тромбоцитарных тромбов, несомненны преимущества тиенопиридинов перед аспирином.
Клопидогрель (плавикс) обладает значительными преимуществами при коронарных вмешательствах, его можно использовать и в острых ситуациях, и долгосрочно. Он имеет хорошую безопасность, переносимость, идеально сочетается с комплексом лечения. Оценка потенциальных преимуществ клопидогреля перед аспирином с точки зрения снижения риска ишемических инсультов, инфаркта миокарда или сосудистой смерти проведена в рандомизированном клиническом испытании Caprie, в котором участовали 384 кардиоцентра из 16 стран 1, 11. Исследования у 19185 пациентов показали, что клопидогрель предотвращает на 26% больше ишемических исходов и на 19,2 % — рисков инфаркта, чем аспирин. Лечение плавиксом сопровождается меньшей частотой желудочно-кишечных и других клинически значимых осложнений, переносимость его существенно выше. Клопидогрель удобен в применении — однократно в день 75 мг, нет необходимости коррекции дозы в зависимости от возраста и функции почек, не требуется стандартного контроля анализов крови. Препарат быстро всасывается с достоверным снижением агрегации тромбоцитов через 2 ч после приема, который не зависит от употребления пищи.
При отсутствии предподготовки больного к коронарной ангиопластике или стентированию необходимо использование «нагрузочной» дозы препарата — 300 мг, которая значительно снижает агрегацию тромбоцитов и удлиняет время кровотечения к моменту вмешательства.
Имеются убедительные данные о дополнительной эффективности сочетанного применения аспирина и клопидогреля (исследования Classics, PCI-CURE), особенно в случаях стентирования коронарных артерий 5, 7—10. Лечение плавиксом в дополнение к аспирину приводит к 30%-ному относительному снижению развития ишемических событий после 30 дней лечения, к 25%-ному — после 12 мес лечения, а назначение его за 10 дней до вмешательства и продолжение лечения после него приводит к 45%-ному снижению риска ишемических событий после 30 дней лечения 10.
Применение клопидогреля, начатое перед процедурой стентирования, должно быть продолжено в течение 3—6 мес после вмешательства и может быть прервано лишь в случаях эффективного стентирования по экономическим причинам через 3—4 мес после операции. После МКШ клопидогрель может быть назначен с конца 1-х—начала 2-х суток после вмешательства.
При необходимости проведения операций АКШ у больных, принимающих клопидогрель, желательно отменять прием препарата за 5—7 дней до вмешательства, в экстренных случаях — за 12 ч, при этом следует более тщательно проводить гемостаз. В случаях появления признаков компрометированного коронарного кровотока у больных после стентирования или МКШ необходимо срочно вернуться к терапии клопидогрелем.
Ингибиторы гликопротеиновых IIb/IIIa-рецепторов тромбоцитов являются относительно новым классом антитромбоцитарных препаратов. По механизму действия их следует отнести к агентам, блокирующим способность гликопротеиновых IIb/IIIa-рецепторов фиксировать на тромбоците фибриноген, т.е. они препятствуют образованию тромбоцитарного тромба. Препараты этой группы представляют собой специфические антитела, пептидные и непептидные блокаторы рецепторов. Наиболее изученными к настоящему моменту являются 4 препарата этого класса: абциксимаб, эптифибатид, тирофибан и ламифибан.
Наибольший эффект получен при использовании этих препаратов при эндоваскулярных вмешательствах 12. Так, в исследованиях EPILOG, EPISTENT, EPIC, CAPTURE показано, что применение абциксимаба значительно снижает риск ранних ишемических осложнений, позволяет уменьшить дозы используемого гепарина, в некоторых случаях эффект баллонной ангиопластики в сочетании с применением абциксимаба соответствует эффекту стентирования 4, 5. Подобные результаты получены и в исследованиях IMPACT II, PURSUIT, RESTORE, PRISM+ c эптифибатидом и тирофибаном 4, 5, 12. Однако до настоящего времени препараты ряда антагонистов гликопротеиновых IIb/IIIa-рецепторов тромбоцитов используются лишь при стентировании коронарных артерий, особенно в случаях повышенного риска (при стентировании артерий малого диаметра, венозных шунтов после АКШ, длительно окклюзированных артерий) и вмешательствах у больных с ОКС. В исследовании EPIС использование абциксимаба привело к снижению частоты развития ОИМ на 39,6%, а в исследовании EPILOG частота развития ОИМ из-за рестенозирования снизилась даже на 58% 4, 5.
Абциксимаб (РеоПро) вводится болюсом за 20—60 мин до начала вмешательства в дозе 0,25 мг/кг, дальше, в течение вмешательства и в послеоперационном периоде, продолжают его инфузию со скоростью 0,1—0,125 мкг/кг в минуту в течение 12 ч (максимум 10 мкг в минуту).
Гепарин нефракционированный в качестве антикоагулянта применяется очень широко — от ОИМ и ОКС до сердечной хирургии и эндоваскулярных вмешательств.
Гепарин прямого ингибирующего действия на тромбин не имеет, действует опосредованно через антитромбин III. Период полувыведения одной дозы гепарина составляет около 60 мин, но может индивидуально значительно варьировать. До 40% введенного гепарина выводится в течение первых 5 мин, далее процесс замедляется. Из-за большой вариабельности скорости выведения чрезвычайно важен периодический контроль содержания препарата в крови пациента. Точный контроль гепариновой антикоагуляции очень важен, поскольку ее недостаточность приводит к активизации свертывающей системы, особенно во время ангиопластики, в результате чего могут развиться тромбоз и острая окклюзия сосуда. Избыточная же антикоагуляция увеличивает риск геморрагии. Глобальным тестом, позволяющим контролировать терапию гепарином, является АЧТВ — активированное частичное тромбопластиновое время, которое свидетельствует об адекватной терапии гепарином, когда показатель увеличен в 1,5—2,5 раза. Однако поддерживать АЧТВ в желаемых пределах удается не более чем у половины больных.
Гепарин используется при эндоваскулярных коронарных вмешательствах и при МКШ в пери– и послеоперационном периоде. При КБА и стентировании он вводится во время процедуры и далее в течение 1-х суток до 25—30 тыс. ед. в сутки внутривенно. Более длительное введение показано после осложненной процедуры стентирования (при ОКС, после реканализации окклюзированной коронарной артерии или венозного шунта, после технически сложного стентирования).
При МКШ в случаях операции в условиях экстракорпорального кровообращения гепарин вводится перед ЭКК в расчетной дозе до полной гепаринизации с последующей нейтрализацией протамин сульфатом и 2—3 дня — в послеоперационном периоде (20—25 тыс. ед. подкожно в 4 приема). При проведении операции без ЭКК гепарин применяется так же, как при рентгено-хирургических вмешательствах.
Низкомолекулярные гепарины (НМГ) представляют собой фракции гепарина, получаемые с помощью ферментативной или химической деполимеризации. Их молекулярная масса составляет 4000—5000 Да (у гепарина — 30000 Да). НМГ имеют ряд преимуществ перед нефракционированным гепарином:
1) большее влияние на фактор Ха;
2) хорошая биодоступность и быстрое всасывание при подкожном введении;
3) более предсказуемое антикоагулянтное действие;
4) отсутствие необходимости лабораторного контроля при их применении;
5) устойчивость к подавляющему действию активированных тромбоцитов;
6) низкая частота тромбоцитопении;
7) возможность 1—2-кратного введения в сутки;
8) отсутствие гиперкоагулянтного эффекта при отмене препарата, что свойственно нефракционированному гепарину.
В ряде крупных многоцентровых рандомизированных исследований (FRIC, FRISC-II, ESSENCE, TIMI-11B, FRAXIS) доказана высокая эффективность использования НМГ в сочетании с аспирином в лечении ОКС 5, 7—9.
При выборе лекарственного средства надо учитывать, что преимущество имеют препараты с наименьшей молекулярной массой (НМГ с молекулярной массой менее 5400 Да обладают преимущественно антитромботической активностью — анти-Х-фактор), т.е. надропарин (фраксипарин), эноксапарин (клексан), потом дальтепарин, гепарин.
НМГ могут быть назначены вместо гепарина в послеоперационном периоде у больных после реваскуляризации коронарных артерий на 2—4 дня и более, если вмешательство было произведено на фоне ОКС.
НМГ вводятся подкожно 1 раз каждые 12 ч болюсом с учетом массы больного и остроты процесса или в двойной дозе однократно (фраксипарин — 0,6 мл). Надропарин (фраксипарин) — 0,1 мл на 10 кг массы тела каждые 12 ч. Инъекционный раствор выпускается в наполненных шприцах, содержащих 0,3, 0,4, 0,6, 0,8 и 1,0 мл фраксипарина. Эноксапарин (клексан) — по 1 мг/кг каждые 12 ч. Шприцы, готовые к употреблению, содержат 20, 40, 60, 80 и 100 мг клексана.
Комбинированная вазодилатационная терапия
Наиважнейшей целью лечения является подготовка артерий к вмешательству и предупреждение возникновения их спазма во время реваскуляризации и после нее. Для этого в протокол ведения больных ИБС, которым предстоит реваскуляризация с помощью стентирования или МКШ, включают антагонисты медленных кальциевых каналов. Наибольшим вазодилатирующим эффектом обладают антагонисты кальция группы дигидроперидинов и бензотиазепинов.
У больных ИБС для постоянного лечения используются дигидропиридины длительного действия, не вызывающие повышения активности симпатоадреналовой системы и нейрогормонов. К ним относится в первую очередь амлодипин (норваск).
Амлодипин улучшает функцию митохондрий, повышая тем самым систолическую и диастолическую функции сердца. Препарат обладает высоким антиангинальным эффектом, увеличивает толерантность к физической нагрузке, не угнетая функции проводимости и автоматизма. Он отличается 24-часовой длительностью действия и самой высокой среди антагонистов кальция биодоступностью. Амлодипин оказывает благоприятное влияние на структурные нарушения в сердечно-сосудистой системе и подвергает обратному развитию гипертрофию миокарда и стенок артерий (исследование THOMS). Подтверждено появление морфологически благоприятных изменений атеросклеротических бляшек в сонных артериях на фоне лечения амлодипином (атеросклеротическая бляшка уплотняется и становится менее тромбогенной). В исследовании PREVENT было показано, что прием 10 мг амлодипина в сутки привел к достоверному снижению всех несмертельных сердечно-сосудистых осложнений на 35%, снижению частоты возникновения нестабильной стенокардии и сердечной недостаточности — на 46%. Имеются данные о снижении рестенозов после КБА на фоне постоянного приема норваска.
Aнтисклеротический эффект амлодипина очень высок. В исследованиях INSIGHT, ELSA отмечено замедленное развитие атеросклероза каротидных и коронарных артерий при использовании антагонистов кальция 13. Антисклеротический эффект препарата подтвержден и отечественными исследователями 11, 13; при длительном приеме амлодипина ими получено достоверное снижение уровней холестерина и триглицеридов на 11,3 и 18,2% соответственно. Уровень ХС ЛПНП уменьшился на 34,4%, количество ХС ЛПВП возросло на 18%, индекс атерогенности снизился на 41—44,6%. Чрезвычайно важным является факт выраженного антиагрегантного эффекта амлодипина, который заключается в снижении АДФ и коллагениндуцируемой агрегации тромбоцитов на 20—50%. Все перечисленные особенности делают амлодипин препаратом, показанным для постоянного лечения больных ИБС, которым предстоит реваскуляризация методом МКШ или стентирования.
Бензотиазепины — дилтиазем, алтиазем — отличаются высокой вазодилатирующей способностью, подавляя функцию проводимости и автоматизма, обладают значительным антиаритмическим влиянием. Поэтому больным со склонностью к тахикардии или аритмии в качестве основного вазодилатирующего агента предпочтительно назначать дилтиазем, преимуществом которого является наличие внутривенно вводимых форм препарата, что позволяет использовать его во время и сразу после вмешательства. Предпочтение отдается препаратам длительного действия.
С целью подготовки артерий к вмешательству и обеспечения непрерывности лечения антагонисты кальция назначаются за 7—14 дней до вмешательства, прием их должен быть продолжен как минимум на 6 мес после процедуры и как максимум — неопределенно долго.
Рекомендуемые препараты: норваск — 5—10 мг 1 раз в сутки; алтиазем или дилтиазем — 180 мг (240 мг) 1 раз в сутки.
Обеспечение восстановления и сохранности эндотелиальной функции коронарных сосудов
Ингибиторы ангиотензинпревращающего фермента (ИАПФ) являются «золотым стандартом» в лечении больных хронической сердечной недостаточностью, артериальной гипертонией и ИБС 2, 9. Предотвращая активацию нейрогормонов, ИАПФ снижают периферический и центральный симпатический тонус, уменьшают симпатическую вазоконстрикцию коронарных сосудов, периферическое сопротивление, снижают пред– и постнагрузку на миокард и тем самым улучшают функцию левого желудочка, способствуя уменьшению его объема и препятствуя ремоделированию. В клинических исследованиях CONSENSUS, V-YTFT II, SOLVD-TREATMENT, SOLVD установлено, что использование в лечении ИАПФ у больных с хронической сердечной недостаточностью и при ОИМ приводит к 40%-ному снижению частоты повторных инфарктов миокарда, вызывает регрессию гипертрофии левого желудочка 2—4. ИАПФ показаны также всем больным, перенесшим нарушения коронарного кровотока в бассейне передней нисходящей артерии.
При проведении реваскуляризации у больных ИБС используются способности ИАПФ вызывать ангиодилатацию, а также их влияние на эндотелиальную функцию — подавление пролиферативных процессов в эндотелии сосудов и миокарде. Применение ИАПФ имеет двухуровневый эффект — немедленный, обусловленный блокадой циркулирующих нейрогормонов, и отсроченный, связанный с постепенной блокадой локальных тканевых нейрогормонов.
У больных ИБС, подлежащих процедуре реваскуляризации, предпочтительно использовать препараты, обладающие в наибольшей степени ангио-, кардиопротективным и антипролиферативным свойствами, т.е. в большей степени проявляющие отсроченный эффект действия. Для обеспечения непрерывности эффекта используются препараты длительного, желательно суточного действия. Чаще всего больные ИБС с показаниями к реваскуляризации уже получают ИАПФ, и приходится лишь корригировать дозы или лекарственные формы препаратов. Но в любых случаях ИАПФ назначаются за 7—10 дней до процедуры, а затем лишь производят коррекцию дозировок. В случаях наблюдающейся у больного нормо– или гипотонии препарат назначается с 1/4 или 1/2 дозы с постепенным ее возрастанием.
Рекомендуемые препараты: периндоприл (престариум) — 4 мг 1 раз в сутки; фозиноприл (моноприл) — 5—10 мг в сутки; лизиноприл (диротон) — 10 мг в сутки; квинаприл (аккупро) — 5—10 мг в сутки.
Бета-адреноблокаторы являются облигатными препаратами у больных ИБС 2, 9. Их благоприятный эффект доказан многочисленными исследованиями (Гетеборгское, Фремингемское, TIBBS, CIBIS-II, MERIT-HF и др.) и обусловлен снижением работы сердца и его энергетических затрат, уменьшением напряжения стенки желудочка, уменьшением потребления миокардом кислорода, снижением симпатической активности и, соответственно, урежением частоты сердечных сокращений и аритмий. Снижая потребление миокардом кислорода, эти препараты повышают количество миокардиальной массы, спасенной при реперфузии, что особенно важно во время реваскуляризации при ОКС или после реканализации окклюзированного коронарного сосуда. Это относится к липофильным бета-адреноблокаторам, активно работающим в зоне ишемии и некроза. Абсолютным преимуществом обладают селективные бета-блокаторы, не обладающие собственной симпатомиметической активностью и лишенные отрицательных воздействий на больных с патологией легких, сахарным диабетом и болезнью периферических артерий.
Селективные липофильные бета-блокаторы уменьшают смертность от ОИМ на 14—25% и частоту реинфаркта — на 18%, частоту фатальных аритмий — на 15%. Они включены в число облигатно назначаемых препаратов при ОКС в рекомендациях ААК/ААС 3. При назначении этих препаратов учитывается их способность уменьшать гипертрофию миокарда, а также антигипоксический и антиангинальный эффекты.
Противопоказанием к назначению бета-адреноблокаторов может служить лишь ЧСС менее 55 ударов в минуту, острая левожелудочковая недостаточность, наличие бронхоспазма или обострения язвенной болезни в момент назначения, АД менее 100 мм рт. ст., наличие атриовентрикулярной блокады II—III степени и критическое заболевание периферических артерий.
Бета-блокаторы применяются для длительной постоянной терапии. Вначале можно использовать низкие дозы (1/4—1/2 обычной дозы) с последующим постепенным пошаговым (за 1—2 нед) увеличением дозы до терапевтической.
Рекомендуемые препараты: метапролол ЗОК (беталок-ЗОК) — 50—100 мг 1 раз в сутки; бисопролол (конкор) — 5—10 мг 1 раз в сутки.
Сочетанный прием бета-блокаторов вместе с дилтиаземом значительно замедляет атриовентрикулярную проводимость и нуждается в тщательном контроле.
Консолидация атероматозной бляшки и предотвращение местной воспалительной и вазоспастической реакции
Больные ИБС в подавляющем большинстве в основе своего заболевания имеют специфические изменения липидного спектра крови, который характеризуется высоким уровнем проатерогенных липидов (ХС ЛПНП, триглицеридов, хиломикронов) и их транспортных белков и низким уровнем антиатерогенного холестерина (ХС ЛПВП) и его транспортного белка. Наиболее перспективной группой гипохолестеринемических препаратов являются статины — ингибиторы 3-гидрокси-3метил-глютарил-коэнзим-А-редуктазы (ГМГ-КоА-редуктазы). В многочисленных многоцентровых рандомизированных исследованиях доказана их высокая гипохолестеринемическая активность и влияние на снижение коронарной заболеваемости и смертности от нее, на снижение частоты инфарктов миокарда, риска коронарных осложнений и необходимости АКШ и КБА (исследования 4S, CARE, LIPID, Post-CABG, AFCAPS/TexCAPS, WOSCOPS, HPS) 1, 14—19. Установлено снижение общей смертности на 30%, коронарной — на 42%, снижение риска АКШ и КБА — от 26 до 37%. Согласно рекомендациям NCEP — Национальной программы по холестерину в США, ХС ЛПНП у больных с риском ИБС не должен превышать 2,6 ммоль/л. Более того, у пациентов с нормальными или умеренно повышенными уровнями липидов, но с риском сердечно-сосудистых заболеваний перспектива здоровья гораздо выше на фоне приема низких доз статинов 14—17.
При назначении статинов эффект начинается со 2-й недели, а значительное снижение уровня липидов крови наступает через 3—6 нед. Устойчивая нормализация уровня липидов происходит в среднем через 1—2 года. После прекращения приема препаратов холестерин возвращается к исходному уровню примерно через 1 мес.
Побочные эффекты приема статинов — тошнота, диарея, сыпь, миалгии, повышение уровня трансаминаз. Только в случае повышения трансаминаз более чем в 3 раза следует отменить или временно прервать лечение.
Больным ИБС, подлежащим процедуре реваскуляризации, статины назначаются не только с целью вторичной профилактики и уменьшения неблагоприятных осложнений основного заболевания. Снижая уровни холестеринов, триглицеридов, они обладают способностью консолидировать бляшку, ее ядро, уплотняют оболочки. Таким образом, они препятствуют появлению нестабильности атероматозной бляшки, предотвращают ее разрушение и диссекцию покрывающего ее эндотелия. Применение статинов при вмешательствах на коронарных артериях обусловлено использованием не только их местного и гиполипидемического действия, но также их системных плеотропных эффектов 18, 19.
Механизмы стабилизации атеросклеротической бляшки при применении статинов (при условии снижения ХС ЛПНП не менее чем на 20—25%):
1) локальные эффекты:
уменьшение липидного ядра (или его стабилизация);
укрепление покрышки (противовоспалительный эффект, влияние на ГМГ-КоА-редуктазу и синтез коллагена);
локальное улучшение функции эндотелия (снижение риска спастических реакций);
2) системные эффекты:
восстановление эндотелийзависимой дилатации сосудов;
положительное влияние на реологию крови и тромбообразование.
Класс статинов достаточно обширен, разные препараты обладают различным гипохолестеринемическим эффектом, вызывают побочные явления разной степени выраженности . В настоящее время хорошо проверен эффект симвастатина (зокора), аторвастатина, ловастатина, правастатина и флювастатина (см. рисунок).
Проведенные исследования по сравнительному действию данных препаратов (TREAT to TARGET, CURVES) показали несомненный приоритет аторвастатина (липримара) 1, 15, 19. Так, назначение его в дозе 10 мг в сутки позволило достичь целевого уровня ХС ЛПНП у 46% больных, зокор в той же дозе дал эффект у 27% пациентов в те же временные сроки. При этом повышение ХС ЛПВП было одинаковым — 7%.
В исследовании MIRACL 18 показан высокий эффект раннего назначения аторвастатина (липримара) при ОКС, которое позволило уменьшить на 16% случаи летальных исходов, развитие острого инфаркта миокарда и ранних повторных госпитализаций. Эти данные, а также исследование COHORT 17—19 позволили сделать заключение о необходимости ранней агрессивной тактики применения статинов в случаях ОКС (назначение статинов снижало смертность на 34%, а сочетание применения статина с реваскуляризацией — на 64%).
Нужно отметить хорошую переносимость аторвастатина, хорошую дозозависимость — исходно повышенный уровень ХС ЛПНП снижался на 39—60%, триглицеридов — на 19—37% в зависимости от дозы препарата — 10—80 мг в сутки.
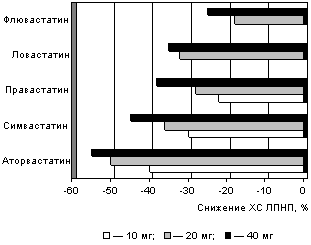 |
| Снижение ХС ЛПНП статинами в разной дозировке |
Необходимо назначать статины как можно раньше до проведения процедуры, желательно за 2—3 нед, и продолжать прием не менее 3—6 мес, лучше постоянно. Применение их требует оценки функции печени и определения липидного профиля до начала лечения, затем через 1, 2 и 6 мес. Превышение уровня ферментов (AлAT, AсAT) более чем в 3 раза требует временной отмены препарата и последующего контроля их значений.
Рекомендуемые препараты: аторвастатин (липримар) — 10—20 мг 1 раз в сутки в любое время; симвастатин (зокор, симгал) — 20—40 мг в сутки на ночь; ловастатин (мевакор) — 20—40 мг в сутки на ночь.
Больные ИБС, которым предстоит или проведена процедура реваскуляризации методом МКШ или стентирования, должны получать препараты всех перечисленных четырех групп. Они хорошо сочетаются, действуют как синергисты, усиливая эффекты друг друга, снижают число неблагоприятных событий; их совместное применение дает значительный прирост эффекта при долгосрочном использовании (см. таблицу).
Обязательная терапия больных, подвергаемых процедурам стентирования или МКШ, выглядит следующим образом:
1) плавикс — 75 мг в сутки за 5 дней до стентирования (но не МКШ), затем в течение 3—4 мес обеим группам больных, тромбо-АСС (или аспирин-кардио) — 100 мг ежедневно на ночь постоянно;
2) норваск — 5 мг или алтиазем (дилтиазем) — 180мг 1 раз в день за 7—10 дней до вмешательства и 5—6 мес после;
3) по индивидуальным показаниям: беталок-ЗОК — 50—100 мг 1 раз в сутки или конкор — 5 мг 1 раз в сутки (постоянно), престариум — 2—4 мг, или моноприл — 5—10 мг, или диротон — 5—10 мг 1 раз в сутки, или квинаприл — 5—10 мг в сутки;
4) аторвастатин (липримар) — 10 мг 1 раз в день в любое время или симвастатин (зокор) — 20 мг 1 раз в день на ночь за 2—3 нед до вмешательства и 5—6 мес после.
В заключение надо подчеркнуть, что проведение унифицированной многокомпонентной терапии препаратами, эффект которых подтвержден методами доказательной медицины, позволяет выполнить все поставленные задачи, т.е. обеспечивает непрерывность лечения до и после вмешательства, подготавливает коронарное и артериальное русла (внутреннюю грудную артерию) к вмешательству, осуществляет защиту подсудных артерий от хирургической агрессии, что обусловливает хорошие результаты эндоваскулярного и хирургического лечения ИБС и уменьшает частоту рецидивов заболевания.
| Предотвращенные неблагоприятные события при совместном применении лекарственных средств (на 1000 пациентов)* |
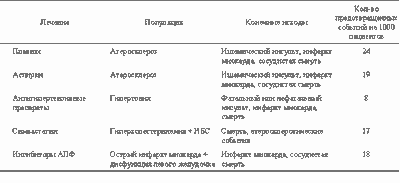 |
Литература
Наумов В.Г., Лупанов В.П. Профилактика рестенозов после ангиопластики, стентирования и коронарного шунтирования. Сердце 2002; 1(5): 138—143.
Чазов Е.И. Ишемическая болезнь сердца и возможности повышения эффективности ее лечения. Клинические исследования лекарственных средств в России 2001; 1: 2—4.
Braunwald E., Antman E.M., Beasley J.W. et al. ACC/AHA guidelints for the management of patients with unstable angina and non-ST-segment elevation myocardial infarction. A Report of American College of Cardiology. American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2000; 21: 970—1062.
Castelli W.P. Making рractical sense of clinical trial data in decreasing cardiovascular risk. Am J Cardiol 2001; 88(1): 16F—20F.
Easthope S.E., Jarvis B. Clopidogrel. Potential in the prevention of cardiovascular events in patients with acute coronary syndromes. Am J of Cardiovascular Drugs 2001; 1(6): 467—476.
Nenci G.G. Единая концепция артериальных сосудистых заболеваний. Eur Heart J 1999; 1 (1A): A27—A30.
Панченко Е.П. Возможности современной антитромботической терапии у больных, перенесших острый коронарный синдром. Сердце 2002; 1(1): 24—29.
Явелов И.С. Антитромбины в лечении острого коронарного синдрома без подъема сегмента ST: современное состояние проблемы. Consilium medicum 2000; 2(11): 1—12.
Грацианский Н.А. Нестабильная стенокардия — острый коронарный синдром без подъемов ST. Антитромботическое лечение. Кардиология 2000; 19: 72—83.
Mehta S.R. et al. Effect of pretreatment with clopidogrel and aspirin followed by long-term therapy in patients undergoing percutaneous coronary intervention: the PCI-CURE study. The Lancet 2001; 358(9281): 527—533.
Атаршикова М.В. Клопидогрель (плавикс) снижает риск развития ишемических осложнений у больных атеросклерозом. Журнал неврологии и психиатрии. Инсульт (приложение) 2001: 1: 58—65.
Lincoff A.M. et al. Sustained suppression of ischemic complications of coronary intervention by GP 11b/111a blokade with abciximab. Circulation 2001; 20: 1951—1958.
Малышева Е.А., Леонова М.В., Прошин А.Ю., Белоусов Ю.Б. Влияние амлодипина на показатели липидного спектра у больных гипертонической болезнью и атеросклерозом сонных артерий (сообщение 3). Клиническая фармакология и терапия 1998; 7(1): 2—4.
Аронов Д.М. Статины снижают смертность и улучшают течение атеросклеротических заболеваний. Consilium medicum 2001; 3(10): 456—463.
Аронов Д.М. Плеотропные эффекты статинов. РМЖ 2001; 9: 13—14.
Карпов Ю.А., Сорокин Е.В. Атеросклероз и факторы воспаления: нелипидные механизмы действия статинов. РМЖ 2001; 9—10: 418—422.
Cannon R.O. Cardiovascular benefit of cholesterol-lowering therapy. Circulation 2000; 22: 820—822.
Белоусов Ю.Б. Эффекты аторвастатина при остром коронарном синдроме: предупреждение ранних повторных ишемических исходов. Фарматека 2001; 11: 27—30.
Оганов Р.Г., Ахмеджанов Н.М. Аторвастатин — новый ингибитор ГМГ-КоА-редуктазы для лечения атеросклероза и гиперлипидемий. Кардиология 2000; 7: 62—67.
| 
