© А.В. Дворников, И.В. Мухина, В.Н. Крылов, 2003 г.
УДК 616.12—.001.6
Поступила 15.01.2003 г.
А.В. Дворников, И.В. Мухина, В.Н. Крылов
Нижегородская государственная медицинская академия; ЦНИЛ, Нижний Новгород
Изменение вариабельности сердечного ритма в условиях эмоционального стресса у крыс на фоне введения блокатора b1-адренорецепторов
Регуляция висцеральных функций организма страдает при целом ряде патологий, таких как диабет, нейроциркуляторная дистония, сердечная недостаточность, инфаркт миокарда и др. Анализ вариабельности сердечного ритма (ВСР) является одним из простых неинвазивных способов оценки вегетативной регуляции организма. Например, уменьшение ВСР служит важным прогностическим признаком у больных, перенесших инфаркт миокарда [1—6]. Подобные изменения вариабельности могут быть предвестником внезапной смерти от сердечных аритмий [2, 6—8]. Если данный факт, подтвержденный множеством клинических исследований, не вызывает сомнений, то механизмы, лежащие в основе этих патологических процессов, практически не изучены. Очевидно, что уменьшение флуктуаций сердечного ритма может возникать в результате редукции модулирующих влияний вегетативной нервной системы вследствие функционального или даже структурного нарушения системы регуляции сердечного ритма.
Существует ряд гипотез возникновения «ригидного» ритма сердца. Первая гипотеза заключается в том, что ригидность сердечного ритма обусловлена усилением симпатических влияний на сердце [1, 3]. Также предполагается [9], что в условиях патологии может наблюдаться защитная реакция в виде нервной изоляции органа. Тогда явление жесткости ритма можно объяснить авторитмическим режимом функционирования и предположить, что единственный путь сердечной регуляции в этот период — гуморально-метаболический.
Эксперимент позволяет моделировать усиление симпатических влияний, например с помощью эмоционального стресса. Известно, что в стрессорных условиях усиливается активность как симпатических, так и парасимпатических звеньев вегетативной регуляции [10, 11]. Чтобы выделить симпатическую компоненту из полученного эффекта, можно блокировать эфферентное звено симпатической нервной системы с помощью блокаторов периферических адренорецепторов сердца.
Материалы и методы. Эксперименты были проведены на белых лабораторных нелинейных крысах-самцах массой 180—220 г в возрасте 12—13 мес.
Иммобилизация животных проводилась в двух модификациях: в нормальном положении (ИНП) в тесной иммобилизационной камере и в положении на спине (ИПС) с фиксацией конечностей [12]. Экспозиция иммобилизации в каждом случае составляла 60 мин. При ее отмене животных помещали в просторную клетку на 15 мин.
ЭКГ у бодрствующих животных регистрировали при помощи жилета оригинальной конструкции во II стандартном отведении. ЭКГ у наркотизированных нембуталом крыс (35 мг/кг, хирургический наркоз 1 степени) снималась с помощью подкожных игольчатых серебряных электродов в положении на правом боку. Запись проводилась исходно, а также на 1, 10, 20, 30, 40, 50 и 60-й минуте регистрации ЭКГ. В серии с иммобилизацией фиксировались 1, 10, 20, 30, 40, 50, 60-я минута иммобилизации и 1-я и 15-я минуты отмены воздействия.
Блокаторы использовали в следующих пороговых дозах: атропин подкожно в дозе 0,4 мг/кг, метопролол внутрибрюшинно в дозе 0,4 мг/кг. В серии с иммобилизацией блокатор вводился перед началом иммобилизации. В контрольных сериях применяли равное количество физиологического раствора.
Анализ ВСР проводился разными методами.
Статистические методы. Для визуальной оценки ВСР использовалось построение кардиоинтервалограммы. В качестве статистических параметров ВСР изучались R—Rср — средний кардиоинтервал, а также различные производные стандартного отклонения ряда R—R-интервалов, предложенные стандартами Европейского кардиологического и Североамериканского электрофизиологического обществ [4, 5, 8]:
CV — коэффициент вариации — стандартное отклонение, нормированное на интервале R—Rср. CV=SDNN/R—Rср·100%;
SDNN — собственно стандартное отклонение временного ряда кардиоинтервалов;
RMSSD — квадратный корень из суммы квадратов разностей величин последовательных пар R—R-интервалов;
SDSD — стандартное отклонение разностей между соседними интервалами R—R;
pNN5 — процент пар R—R-интервалов, отличающихся более чем на 5 мс (модифицированный для крыс pNN50) [13].
Спектральные методы. Спектральный анализ ряда R—R-интервалов проводился на основе алгоритма быстрого преобразования Фурье с использованием всех точек без сглаживания. Спектр разделялся на следующие диапазоны частот для крыс [13]: НЧ (0,195 — 0,74 Гц) и ВЧ (0,78 — 2,5 Гц). В оценке ВСР использовались суммарная спектральная мощность (TP) (0,195—2,5Гц), абсолютная мощность НЧ-(PLF) и ВЧ-диапазонов (PHF) в мс2 , отношение мощностей НЧ– и ВЧ-диапазона (L/H).
Нелинейно-динамические методы. Нелинейная волновая структура кардиоритма оценивалась по графическому отображению временного ряда интервалов R—R на фазовой плоскости (хаосграмме). Геометрический анализ циклов нелинейных волн проводился при помощи построения гистограммы рейтинга хаос-теста [14]. По данным этой гистограммы рассчитывался коэффициент ОЦНВ — отношение абсолютного числа циклов нелинейных волн с количеством точек в них более 4 к числу циклов с точками 2—3.
В качестве критерия наличия хаотической структуры в сердечном ритме использовался показатель (экспонента) Ляпунова (LLE). Считалось, что если LLE>0, то имеются хаотические колебания, если LLEш0, то их нет [15].
Математическая обработка результатов исследования. Построение кардиоинтервалограммы с привязкой к R-зубцу с точностью 1 мс осуществлялось с помощью программы «Rhythm-service 1.0». Для анализа ВСР использовались визуально выделенные участки кардиоинтервалограммы длиной 100R—R без артефактов. Хаосграмма и гистограмма рейтинга хаос-теста оценивались в программе «Валеометр» [14]. Экспонента Ляпунова анализировалась с применением программы «Santis 1.1».
Полученные данные были обработаны с помощью программ Microsoft Exсel и Statistica 5.0. Показатели TP, PLF, PHF и RMSSD были нормализованы с помощью функции натурального логарифма, pNN5 — квадратного корня. Парные внутригрупповые сравнения средних производили по t-критерию Стьюдента для зависимых выборок. Для межгруппового сравнения использовался дисперсионный анализ. Различия считали достоверными при уровне значимости р < 0,05.
Результаты и обсуждение. Данные получены для 4 случаев иммобилизации.
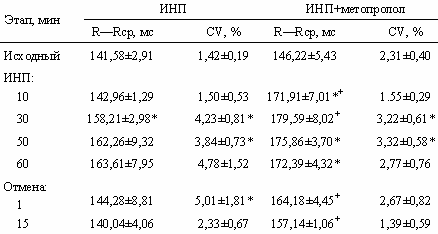
Иммобилизация в нормальном положении (ИНП). В условиях такой иммобилизации не наблюдается связанных с данным воздействием хронотропных реакций сердечного ритма у крысы (табл. 1). CV увеличивается к 30 мин в 2 раза, а к 50 мин — в 2,7 раза относительно исходного уровня. После отмены иммобилизации он возвращается к исходным значениям. Различий с контрольной серией не обнаружено, следовательно, увеличение CV связано с адаптацией организма животного к внешним условиям.
Спектральный анализ показывает аналогичное показателям среднеквадратичного отклонения повышение TP, PLF, PHF относительно базового уровня к 30, 50, 60-й минуте иммобилизации. Однако в отличие от контрольной серии увеличение мощности спектра происходит с увеличением преобладания высокочастотной модуляции сердечного ритма. L/H на 10-й минуте ИНП достоверно ниже значений в контрольной серии на 26%, а к 30-й минуте ИНП уменьшается на 65%, к 50-й минуте составляет 46% от базового уровня. Таким образом, в условиях ИНП увеличивается модуляция сердечного ритма, в его структуре преобладают ВЧ-колебания.
В ходе ИНП наблюдается тенденция к повышению показателя ОЦНВ, который к 10-й минуте повышается на 85% относительно начальных значений. LLE увеличивается в среднем в 4 раза к 30-й и 50-й минутам иммобилизации. После отмены ИНП происходит восстановление экспоненты Ляпунова к исходному уровню.
Таким образом, данное воздействие является очень слабым стрессорным фактором для взрослых крыс.
Иммобилизация в нормальном положении на фоне метопролола. В условиях ИНП на фоне пороговой дозы метопролола зарегистрировано более выраженное замедление ритма в сравнении с контрольной серией ИНП, сохраняющееся даже к 10-й минуте отмены ИНП (см. табл. 1).
Таблица 1
Показатели ВСР в серии с ИНП и ИНП на фоне метопролола
|
 |
* — достоверные различия относительно исходных значений,
+ — относительно серии с ИНП (p<0,05). |
Это обусловлено уменьшением влияния симпатической регуляции при частичной блокаде b1-адренорецепторов. В данной серии ВСР, на первых минутах сниженная, увеличивается с запозданием по сравнению с контрольной серией ИНП, что может говорить о том, что влияние на ВСР, опосредованное адренергическими структурами, не сильно выражено.
Коэффициент ОЦНВ уменьшается к 20-й минуте после введения b1-адреноблокатора на фоне ИНП относительно серии с ИНП без блокаторов. Тем не менее, к 50-й минуте он увеличивается в 2,2 раза относительно исходных значений, а отмена воздействия вызывает его восстановление до исходного состояния.
Таким образом, частичная b1-адренорецепторная блокада в условиях иммобилизации незначительно влияет на линейные и нелинейные свойства системы регуляции сердечного ритма, т. е. в данных условиях симпатическая регуляция его слабо выражена. Было сделано предположение, что более жесткая иммобилизация животных в положении на спине с фиксацией конечностей вызовет усиление симпатической активности.
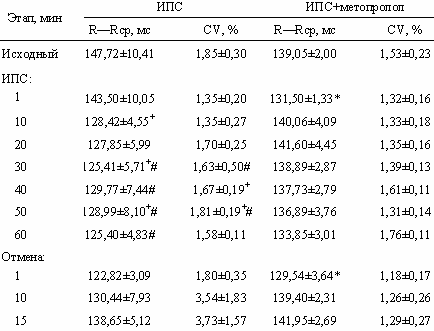
Иммобилизация в положении на спине. Действительно, в условиях ИПС интервал R—Rср в сравнении с серией ИНП достоверно ниже на 10—50-й минуте на 10—20% соответственно, а в сравнении с контролем — к 30—60-й минуте ниже на 23—27% соответственно (табл. 2),
Таблица 2
Показатели ВСР в серии с ИПС и ИПС на фоне метопролола
|
 |
* — достоверные различия относительно исходных значений,
+ — относительно серии с ИНП, # — относительно контрольной серии (p<0,05). |
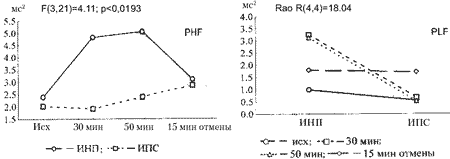
т. е. средний кардиоинтервал сохраняется на исходно низких значениях. CV достоверно отличается, во-первых, от серии с ИНП к 30—50-й минуте в меньшую сторону, составляя 38—47% соответственно, и, во-вторых, от контрольной серии к 40—50-й минуте, составляя 57—60% соответственно, т. е. в условиях ИПС наблюдается малоподвижный жесткий ритм при высокой ЧСС. Остаются сниженными, не отличаясь от исходных, спектральные показатели ВСР. Достоверное отличие поведения спектральных показателей в сравнении с серией ИНП показано на рис. 1.
Рис. 1. Изменение показателей PHF и PLF при вариантах иммобилизации ИНП и ИПС.
Данные дисперсионного анализа показывают достоверное влияние группирующего
фактора (PLF) и взаимодействие данного фактора и фактора повторных измерений (PHF)
|
 |
Коэффициент ОЦНВ в условиях иммобилизации животного на спине не испытывает заметных изменений, оставаясь на значениях, близких к 0,77. К 10-й минуте иммобилизации LLE составляет всего 15% относительно базового уровня, к 20-й минуте — 43%. В условиях ИПС он достоверно ниже значений в контроле к 1, 10, 30 и 50-й минуте на 40, 81, 86 и 90% соответственно. Важно отметить, что к 1-й минуте отмены иммобилизации число Ляпунова достоверно увеличивается.
Полученные данные свидетельствуют о том, что повышенный симпатический тонус в условиях эмоционального стресса сопровождается сниженными показателями ВСР.
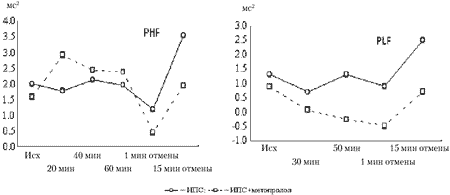
Иммобилизация в положении на спине на фоне метопролола. Иммобилизация на фоне метопролола вызывает увеличение ВСР преимущественно за счет усиления ВЧ-модуляций ритма. Так, к 30-й и 40-й минутам ИПС CV становится выше исходного уровня в 1,4 и 1,9 раз соответственно (см. табл. 2). RMSSD и SDSD достоверно отличаются к 40-й минуте ИПС, составляя 135 и 132% от исходных значений. К 40-й минуте иммобилизации на фоне метопролола наблюдается незначительное недостоверное повышение PHF относительно исходной величины, тогда как PLF достоверно ниже на 50-й минуте относительно контрольной серии с ИПС. В то же время, отмена воздействия сопровождается сниженными спектральными показателями в сравнении с контрольной серией с ИПС (рис. 2).
Изменение спектральных показателей вариабельности PHF и PLF
при ИПС и ИПС на фоне метопролола. Данные дисперсионного анализа
показывают различие PHF на 15-й минуте отмены, p < 0,029;
PLF к 50-й минуте, р < 0,009
|
 |
L/H к 40-й минуте составляет всего 29% от исходного значения.
Таким образом, частичное освобождение из-под тонического влияния симпатической нервной системы в условиях эмоционального стресса вызывает увеличение ВСР, вероятно, обусловленное усилением модулирующей активности парасимпатической нервной системы.
Заключение. Кратковременная гипокинезия при иммобилизации в нормальном положении у крыс приводит к повышению ВСР с преобладанием парасимпатической регуляции, увеличению хаотических свойств сердечного ритма. Т. е. данное кратковременное воздействие не является стрессорным фактором для взрослых крыс.
Эмоциональный стресс при иммобилизации крысы в положении на спине достоверно снижает вариабельность ритма, уменьшается мощность спектральных показателей ВСР и ослабляются нелинейные свойства ритма сердца. Иммобилизация сопровождается ослаблением парасимпатических модуляций сердечного ритма, что связано с повышением симпатического тонуса в условиях эмоционального стресса при активации корковых влияний на нижележащие центры вегетативной регуляции, что подтверждено в работе [16]. Возможно, выявленный нами факт можно объяснить тем, что в условиях стресса эндогенный кортикотропинвысвобождающий гормон уменьшает вагусный ответ [11], в результате чего снижается парасимпатическая модуляция ритма, и, как следствие, ВСР. Блокада эфферентного звена симпатической нервной системы в данных условиях повышает ВСР, преимущественно в результате усиления высокочастотной, вагусной модуляции ритма сердца. Полученные данные подтверждают гипотезу о том, что усиление симпатического влияния может быть причиной уменьшения вариабельности ритма сердца.
Литература
- Баевский Р.М., Кириллов О.И., Клецкин С.З. Математический анализ изменений сердечного ритма при стрессе. М: Наука; 1984; 221 c.
- Борисов В.И. Анализ вариабельности сердечного ритма в оценке состояний больных инфарктом миокарда. Нижний Новгород: Изд-во НГМА; 1997.
- Литвицкий П.Ф. Закономерности и роль изменений симпатической и парасимпатической регуляции сердца при его локальной ишемии и реперфузии. Пат физиол и эксп терапия 1997;2: 13-18.
- Рябыкина Г.В., Соболев А.В. Анализ вариабельности ритма сердца. Кардиология. 1996; 36 (10):87—97.
- Рябыкина Г.В., Соболев А.В. Вариабельность ритма сердца. М: Изд-во «Оверлей»; 2001; 200 c.
- Сметнев А.С., Жаринов О.И., Чубучный В.Н. Вариабельность ритма сердца, желудочковые аритмии и риск внезапной смерти. Кардиология 1995; 35, (4):49—52.
- Матусова А.П. Клиническое значение статистического анализа сердечного ритма у больных с острым инфарктом миокарда. Кардиология 1989; 29(1): 29—32.
- Task force report of European Society of Cardiology and the North American Society of Pacing and Electrophysiology. Heart rate variability: standards of measurement, physiological interpretation and clinical use. Circulation 1996; 96: 1043—1065.
- Хитров Н.К. Изоляция от нервных влияний как механизм приспособления биологических систем в патологии. Бюлл эксп биол и мед 1998;125 (6): 8—14.
- Физиология человека.Под ред. Н. А. Агаджаняна СПб; 2000.
- Nijsen M. J., Croiset G., Diamant M., Stam R., Kamphuis P. J., Bruijnzeel A., de Wied D., Wiegant V.M. Endogenous corticotropin-releasing hormone inhibits conditioned-fear-induced vagal activation in the rat. Eur J Pharmacol 2000; 389 (1): 89—98.
- Pitman D. L., Ottenweller J. E., Natelson B.H. Plasma corticosterone levels during repeated presentation of two intensities of restraint stress: Chronic stress and habituation. Physiol Behav 1988; 43: 47—55.
- Ramaekers D. Effects of melanocortins and N-terminal proopiomelanocortin on cardiovascular function and autonomic dynamics. 1999. 131 р.
- Гаврилушкин А.П., Киселев С.В., Медведев А.П., Шелепнев А.В., Маслюк А.П. Геометрический анализ нелинейных хаотических колебаний в оценке вариабельности ритма сердца. Учеб.-метод. пособие для студентов и врачей. Нижний Новгород; 2001.
- Wolf A., Swift J.B., Swinney H.L., Vastano J.A. Determining Lyapunov numbers from a time series. Physica 1985; 16D: 285—317.
- Blanc J., Grichois M. L., Vincent M., Elghozi J.L. Spectral analysis of blood pressure and heart rate variability in response to stress from air-jet in the Lyon rat. J Auton Pharmacol 1994; 14 (1): 37—48.
|

