© Н.Б.Киреева, Л.А.Хафизова, В.В. Паршиков,
М.Ю.Заугаров, Д.Я.Алейник, 2003 г.
УДК 616.62—009.1—053.2—072.1
Поступила 19.06.2003 г.
Н.Б.Киреева, Л.А.Хафизова, В.В. Паршиков,М.Ю.Заугаров, Д.Я.Алейник
Нижегородская государственная медицинская академия;
Областная детская клиническая больница, Нижний Новгород
Эндоскопическая коррекция пузырно-мочеточникового рефлюкса у детей с использованием ауто- или аллофибробластов
Пузырно-мочеточниковый рефлюкс (ПМР), представляющий собой ретроградный ток мочи из мочевого пузыря в верхние мочевые пути, встречается с частотой 1% среди здорового детского населения, 21% — у детей, страдающих инфекцией мочевыводящих путей, 50—70% — у больных с хроническим пиелонефритом. При несостоятельности уретеровезикального соустья ток мочи ведет к повышению внутримочеточникового и внутрилоханочного давления, угнетению сократительной активности мочеточника и лоханки, лоханочно-почечному рефлюксу. Указанные расстройства уродинамики способствуют возникновению и рецидивирующему течению пиелонефрита с нарушением структуры и функции почки, развитию рефлюкс-нефропатии с наличием локальных или генерализованных рубцов в паренхиме почки, артериальной гипертензии. Все это обусловливает необходимость своевременного лечения ПМР. Основным способом лечения ПМР является оперативный, преимущество которого заключается в быстром достижении прекращения регургитации мочи [1]. Однако при всем многообразии методов антирефлюксных операций, частота рецидивирования рефлюкса, по данным литературы, колеблется от 3 до 40%, причем ближайшие результаты при некоторых видах операций лучше отдаленных. Частота стеноза мочеточника в отдаленные сроки после операции достигает 5,1%; возникновение рефлюкса в контрлатеральное устье — от 8 до 15—20%; обострение хронического пиелонефрита — до 6% [2].
Кроме того, сама операция, а при необходимости — повторная, является сложным, травматичным и дорогим вмешательством. Оперативное лечение предполагает также длительные сроки госпитализации.
Эндоскопическая коррекция, предложенная в 1981 г. E.Matoushek, является альтернативой оперативному лечению ПМР. В качестве фиксирующих веществ, вводимых под устье мочеточника, применяют тефлоновую пасту [3, 4], силикон [5], препараты гиалуроновой кислоты [6], гель «Интерфалл» [7], гель «Формакрил» [8, 9].
Изучение отдаленных результатов показало, что тефлон опасен в применении, так как является канцерогенным веществом. Имеется риск сосудистой миграции препарата в жизненно важные органы: головной мозг, печень, легкие. Кроме того, возможен стеноз мочеточника в месте его введения [10]. Силикон также является синтетическим материалом, имеет те же недостатки, что и тефлон, в связи с чем его применение в практике также должно быть ограничено.
Наиболее широко в качестве фиксирующего вещества при эндоскопическом лечении ПМР применяют коллаген [11—13]. A. Haferkamp с соавт. используют бычий коллаген в концентрации 35 мг/мл на 1,5—1,6 мл раствора, который вводится субуретерально [13]. Для пролонгированного действия препарат вводят двухкратно. Но и его применение имеет большое число неудач [10, 14, 15]. В связи с частым рецидивом рефлюкса коллаген приходится вводить двух– и трехкратно. Поскольку вещество имеет животное происхождение, возможно развитие иммунной реакции на его внедрение. Кроме того, определенные ограничения вызывает высокая стоимость препарата.
Иногда при эндоскопическом лечении ПМР используют аутологичные субстанции: хондроциты, мышечные клетки [16]. A.A. Caldamone, D.A.Diamond применили эндоскопическое трансуретеральное введение аутологичных хондроцитов в тригональную зону у 29 детей с ПМР II—IV степени с хорошим эффектом [17].
Эндоскопическое субуретеральное введение культуры ауто– или аллофибробластов человека является альтернативой использования бычьего коллагена или других чужеродных материалов, эффект от применения которых непродолжителен [18—20]. Обладая минимальной инвазивностью, эти препараты делают простой и эффективной процедуру коррекции ПМР, как впервые выявленного, так и при рецидиве рефлюкса после неудачного оперативного лечения.
В норме фибробласты продуцируют компоненты экстрацеллюлярного матрикса, одним из которых является коллаген I типа, и более 140 различных факторов роста. Безусловно, естественные коллагеновые волокна более резистентны к ингибированию протеазами, чем, например, используемый бычий коллаген, в котором телопептиды «разрезаны». В эксперименте in vitro показано, что культивированные фибробласты сохраняют способность размножаться и продуцировать коллаген и не являются онкогенными in vivo для животных. У пациентов введение культивированных фибробластов внутрикожно не вызывает образования рубцов и фиброза [20]. Живой клеточный трансплантат будет длительно продуцировать необходимое количество коллагена.
Культуру ауто– или аллофибробластов человека наряду с одногруппной плазмой и коллагеном с целью коррекции ПМР мы в клинике НГМА применяем с 2001 г. (заявка на изобретение № 2002 129065, приоритет от 31.10.2002 г.). Исходный материал для культивирования фибробластов получаем из биоптата собственной кожи пациента за 3—4 нед до операции. Биоптат размером 5—10 мм забирается с кожи предплечья или заушной области после анестезии 0,5% раствором новокаина во флакон со средой «Игла» с антибиотиком и антимикотином. Источником аллогенных фибробластов служит здоровая кожа, полученная после операции «circumcisio». Кожа, удалённая во время операции, помещается во флакон со средой «Игла» и доставляется в лабораторию. Кровь больного перед операцией обследуется на HbsAg, ВИЧ, RW.
Клеточные культуры получаем традиционным методом. Для трансплантации используем культуры 4—10 пассажей, стерильные, неконтаминированные микоплазмами и вирусами. Стерильность контролируется ежедневно микроскопически, контаминация — с помощью полимеразной цепной реакции в лаборатории Нижегородского НИИ эпидемиологии и микробиологии перед трансплантацией культуры.
Для трансплантации применяются культуры хорошего качества, сформировавшие конфлюэнтный монослой, клетки должны быть четко очерченными, с плотными ядрами, выраженными отростками. В день операции клетки снимаются с поверхности культурального сосуда с помощью трипсинизации, дважды отмываются стерильным физиологическим раствором хлористого натрия, концентрация клеток доводится в объеме до 3,5—7 млн./мл, они помещаются в стерильную пробирку и в стерильном биксе доставляются в операционную. Ауто– и аллофибробласты человека получают в лаборатории консервации тканей научно-лабораторного отдела Нижегородского НИИ травматологии и ортопедии МЗ РФ.
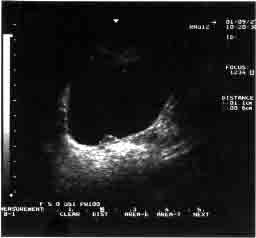 |
| На эхограмме — подслизистый бугорок в области левого устья мочеточника на 3-и сутки после эндоскопического введения культуры аллофибробластов у больной Н., 12 лет |
Для выполнения операции используются цистоскопы ф. «Karl Shtorz» соответствующих возрастных диаметров. Эндоскопия проводится под внутривенным наркозом калипсолом. С помощью специальной инъекционной иглы, проведенной через рабочий канал цистоскопа, ауто– и аллофибробласты человека в количестве 3,5—7 млн. клеток, содержащихся в 1,5—2,0 мл физиологического раствора, вводятся под слизистую оболочку мочеточника на расстоянии 4—5 мм ниже его отверстия, в бессосудистой зоне, на 5—6—7-м эндоскопических часах, до полного смыкания устья на вершине образовавшегося подслизистого бугорка. Дренирование мочевого пузыря уретральным катетером Фолея осуществляется в течение 24 ч. УЗИ почек и мочевого пузыря проводится на 1—2-е сутки после манипуляции. Выписывают больных на 2—3-и сутки. Контрольная цистография выполняется через 6 мес.
Эндоскопическое введение культуры аллофибробластов человека выполнено 20 больным с ПМР II—IV степени (II степени — 10 больных, III степени — 9 больных, IV степени — 1 больная). У 4 детей отмечен рецидив ПМР после антирефлюксной операции Коэна, а у 5 — после эндоскопической фиксации одногруппной плазмой. Возраст детей варьировал от 2 до 12 лет. Девочек было 19, мальчиков — 1. Правосторонний рефлюкс наблюдался у 11 больных, левосторонний — у 8, у 1 девочки был двухсторонний ПМР. Первичный ПМР установлен у 13 больных (65%). У 6 больных он был вторичным на фоне нейрогенной дисфункции мочевого пузыря или хронического цистита. У 1 больной ПМР сочетался с удвоением верхних мочевых путей.
Ни у кого из больных в процессе лечения не возникло кровотечений, обострения хронического пиелонефрита. При контрольном УЗИ явлений обструкции с расширением верхних мочевых путей не наблюдалось. В области устья мочеточника у всех больных сформирован подслизистый бугорок, зафиксированный при эхолокации (см. рисунок).
При анализе результатов лечения учитывался характер рефлюкса: первичный или вторичный, а эффективность оценивалась по изменению степени рефлюксации и течению воспалительного процесса через 6 мес — 1 год после эндоскопической коррекции. При этом наилучшие результаты были достигнуты при лечении первичного ПМР. Положительный эффект от коррекции культурой аллофибробластов составил 80%. У 1 больной с рецидивом ПМР повторно введён коллаген с хорошим непосредственным результатом.
Не удалось устранить ПМР IV степени у 1 больной с нейрогенной дисфункцией мочевого пузыря, дисплазией мочевых путей. Отсутствие или резкое снижение числа обострений пиелонефрита отмечено у всех больных.
Применение ауто– или аллофибробластов при лечении пузырно-мочеточникового рефлюкса у детей обеспечивает более длительную защиту пузырно-мочеточникового соустья. Эти живые фибробласты производят коллаген в месте введения, служа препятствием для регургитации мочи.
Использование человеческих клеток, тем более собственных, позволяет значительно снизить число иммунных реакций. Кроме того, немаловажную роль играет экономический эффект — получение фибробластов во много раз дешевле использования коллагена.
Таким образом, применение ауто– или аллофибробластов при эндоскопическом лечении ПМР повышает эффективность коррекции порока вследствие пролонгированного действия препарата, отсутствия или снижения иммунных реакций, невысокой стоимости. Полученные результаты их использования у детей с ПМР позволяют рекомендовать их для внедрения в широкую клиническую практику.
Литература
- Джавад-заде М.Д., Гусейнов Э.Я. Сравнительная характеристика антирефлюксных операций, причины рецидивирования пузырно-мочеточникового рефлюкса у детей. Урология и нефрология 1998; 6: 16—19.
- Лопаткин Н.А., Пугачёв А.Г. Пузырно-мочеточниковый рефлюкс. М: Медицина; 1990; 208 с.
- Неменова А.А., Чепуров А.К. Эндоскопическая коррекция пузырно-мочеточникового рефлюкса инъецированием тефлоновой пасты. Урология и нефрология 1993; 2: 7—10.
- Kumar R., Puri P. Endoscopic correction of vesicoureteral reflux in failed reimplantated ureter. Eur Urol 1998; 33(1): 98—100.
- Herz D., Hafez A. et al. Efficacy of endoscopic subureteral polydimethylsiloxane injection for treatment of vesicoureteral reflux in children: a north american clinical report. J Urol 2001; 166 (5): 1880—1886.
- Lackgren G., Wahlin N., Stenberg A. Endoscopic treatment of children with vesico-ureteric reflux. Acta Paediatr Suppl 1999; 88 (431): 62—71.
- Соловьев А.Е. Этюды детской урологии. Запорожье; 2001.
- Островский Н.В., Долгов Б.В. и др. Коррекция пузырно-мочеточникового рефлюкса у детей субуретеральной инъекцией полиакриламидного геля «Формакрил». Анналы хирургии 2000; 6: 68—72.
- Осипов И.Б., Лебедев Д.А., Соснин Е.В., Осипов А.И. Результаты эндоскопической коррекции пузырно-мочеточникового рефлюкса у детей. В кн.: Материалы X Российского съезда урологов. М; 2002; с. 763.
- Dodat H. Endoscopic treatment of vesicorenal reflux in children. Arch Pediatr 1994; 1(1): 93—100.
- Бабанин И.Л., Казанская И.В., Коноплёв В.Д. Эффективность эндоскопического лечения пузырно-мочеточникового рефлюкса у детей с использованием биоимплантатов. В кн.: Материалы X Российского съезда урологов. М; 2002; с. 698—699.
- Байбиков Р.С., Ахунзянов А.А., Тахаутдинов Ш.К. Эндоколлагенопластика устья мочеточника при пузырно-мочеточниковом рефлюксе у детей. В кн.: Материалы I Всероссийского конгресса 16—19 октября 2002 г. М; 2002; с. 388—389.
- Haferkamp A., Mohring K. et al. Pitfalls of reped subureteral boving collagen injection for the endoscopic treatment of vesicoureteral reflux. J Urology 2000; 163(6): 1919—1921.
- Haferkamp A., Contractor H. et al. Failure of subureteral bovine collagen injections for the endoscopic treatment primary vesicoureteral reflux in long-term follow-up. J Urology 2000; 55(5): 759—763.
- Trsinar B., Cotic D., Oblak C. Possible causes of unsuccessful endoscopic collagen treatment of vesicoureteric reflux in children. Eur Urol 1999; 36 (6): 635—639.
- Diamond D.A., Caldamone A.A. Endoscopic correction of vesicoureteral reflux in children using autologic chondrocytes: preliminary results. J Urol 1999; 162 (3, Pt 2): 1185—1188.
- Caldamone A.A., Diamond D.A. Long-term results of the endoscopic correction of vesicoureteral reflux in children using autologous chondrocytes. J Urology 2001; 165 (6, Pt 2): 2224—2227.
- Саркисов Д.С., Фёдоров В.Д. и др. Использование культивированных фибробластов для восстановления кожных покровов у тяжелообожжённых. Бюллетень экспериментальной биологии и медицины 1995; 6: 566—570.
- Воздвиженский С.И., Клембовский А.И. и др. Лечение глубоких ожогов у детей с применением культуры аллофибробластов. Педиатрия 1996; 4: 50—56.
- Келлер Г. Сохранность инъецируемых аутологичных человеческих фибробластов. Бюллетень экспериментальной биологии и медицины 2000; 130 (8): 203.

