© А.В.Масленникова, И.Г.Терентьев, В.С.Базанов, 2002 г.
УДК 616.32—006:615.849.7+832
Поступила 1.07.2002 г.
А.В.Масленникова, И.Г.Терентьев, В.С.Базанов
Государственная медицинская академия, Нижний Новгород
Терморадиотерапия у больных орофарингеальным раком III—IV стадии
Почти у 75% больных раком гортани, ротоглотки и гортаноглотки к началу специфического лечения обнаруживаются III—IV стадии заболевания [1]. Лучевая терапия в этой ситуации является ведущим, а часто и единственно возможным методом лечения [2]. Неудовлетворительные показатели выживаемости данного контингента больных обусловлены необходимостью подведения к опухоли и метастазам доз излучения, превышающих толерантность нормальных тканей. С целью улучшения результатов лечения без усиления ранней и поздней токсичности используются различные схемы нестандартного фракционирования, химиотерапевтические препараты и другие радиомодифицирующие агенты [3—6].
Одним из наиболее распространенных универсальных радиомодификаторов является гипертермия, т.е. нагрев зоны опухоли в определенном температурно-экспозиционном режиме. Доказано, что вследствие подавления процессов репарации, сниженных по сравнению с нормальными тканями адаптационных возможностей опухоли по отношению к нагреву за счет неполноценного кровотока, собственного повреждающего действия на опухолевые клетки она является «идеальным» адъювантом лучевого воздействия на опухоль и позволяет достичь значительного терапевтического выигрыша без увеличения лучевой нагрузки на здоровые ткани 7. Гипертермия широко использовалась при лучевой терапии опухолей головы и шеи во всех стадиях заболевания 8—11. В результате ее применения для лечения метастазов плоскоклеточного рака головы и шеи в лимфатические узлы при излеченном или невыявленном первичном очаге было достигнуто значимое увеличение пятилетней выживаемости 12—15. Существенно меньше информации имеется об использовании нагрева для улучшения результатов лечения орофарингеального рака с метастазами в лимфатические узлы.
Цель исследования — изучение эффективности локальной микроволновой гипертермии в сочетании с лучевой терапией у данной категории пациентов.
Материалы и методы.
В исследование были включены 102 больных раком ротоглотки, гортаноглотки и гортани III—IVA стадии, закончивших лечение от 68 до 6 мес до начала изучения (анализ проводился по данным на март 2001 г.). Основным критерием выбора больных было поражение метастазами регионарных лимфатических узлов. В исследование не включались больные с размером конгломерата узлов более 6 см, так как аппаратура для микроволновой гипертермии (915 МГц) не позволяет провести их адекватный нагрев.
В зависимости от варианта лечения больные были разделены на две группы. В первую группу вошли 46 пациентов, получавших дистанционную лучевую терапию в сочетании с локальной микроволновой гипертермией. Больным второй группы (56 человек) проводили лучевую терапию в стандартном режиме. В обеих группах лечение проводили расщепленным курсом в 2 этапа с интервалом 16 дней. Сведения о больных представлены в таблице.
| Общие сведения о больных |
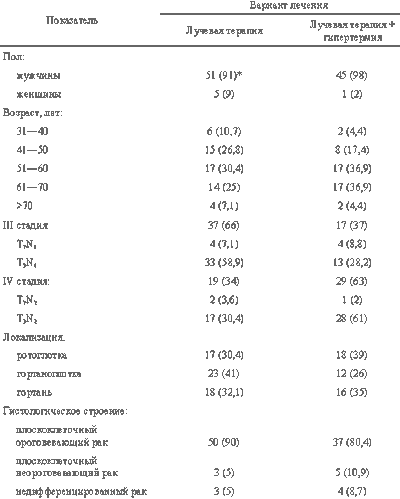 |
Возраст больных в группе терморадиотерапии (46 человек) колебался от 34 до 76 лет, причем 34 из них (73,8%) были в возрасте от 51 до 70 лет. 17 пациентов (37%) имели распространение опухоли, соответствующее III, 29 (63%) — IV стадии заболевания. Морфологическая верификация диагноза получена у всех больных, причем плоскоклеточный ороговевающий рак обнаружен у 37 (80,4%), неороговевающий — у 5 (10,9%), недифференцированный — у 4 (8,7%). Первичная опухоль локализовалась в ротоглотке у 18 (39%), в гортаноглотке у 12 (26%), в гортани у 16 (35%) пациентов.
В группе лучевой терапии (56 больных) возраст колебался от 31 до 76 лет, 46 из них (82%) были в возрасте от 51 до 70 лет. 37 пациентов (66%) имели III, 19 (34%) — IV стадию заболевания. Диагноз подтвержден при гистологическом исследовании у всех больных, плоскоклеточный ороговевающий рак обнаружен у 50 (90%), неороговевающий — у 3 (5%), недифференцированный — 3 (5%). Первичная опухоль исходила из ротоглотки у 17 (30,4%), из гортаноглотки — у 23 (41%), из гортани — у 16 (28,6%) больных.
Таким образом, обе группы были сравнимы по распространенности опухолевого процесса, возрасту, общему состоянию, морфологическому строению и другим параметрам, характеризующим опухолевый процесс и оказывающим влияние на прогноз заболевания, за исключением того, что в группе с применением локальной гипертермии преобладали больные с IV стадией заболевания (63 против 34%). Специальные методы рандомизации не применялись, однако попадание больных в ту или другую группу было практически случайным.
В первой, основной, группе облучение проводилось с помощью аппаратов для дистанционной гамма-терапии в режиме дробного (стандартного) фракционирования. После подведения к первичному очагу и метастазам дозы 10—12 Гр лучевую терапию сочетали с локальной гипертермией по следующей схеме: облучение в дозе 2 Гр — четырехчасовой перерыв — сеанс локальной гипертермии — облучение в дозе 2 Гр непосредственно после него. Локальная гипертермия осуществлялась с помощью аппарата «Яхта-3М» (рабочая частота 915 МГц, мощность во время сеанса 45—55 Вт) в течение 50 мин непосредственно перед вторым сеансом облучения 2—3 раза в неделю. Общее число сеансов за курс лечения — от 6 до 10. Лучевая терапия проводилась расщепленным курсом с двухнедельным перерывом после подведения суммарно-очаговой дозы 44 Гр. Суммарно-очаговая доза за два этапа составляла от 68 до 72 Гр.
Больным контрольной группы проводилась дистанционная гамма-терапия в режиме стандартного фракционирования (2 Гр 5 раз в неделю). Облучение проводилось на аппаратах дистанционной гамма-терапии (Со60) по общепринятым программам. Первичная опухоль облучалась с двух противолежащих полей. При наличии конгломерата увеличенных лимфатических узлов на шее облучение проводилось с переднего и заднего полей до суммарно-очаговой дозы 44—46 Гр, а затем локальным полем до 68—72 Гр.
Непосредственные результаты лечения оценивались через 4 нед после его окончания по данным клинического осмотра, осмотра ЛОР-врача и УЗИ лимфатических узлов шеи.
Сроки наблюдения за больными составляли от 6 до 68 мес.
Анализ актуариальной общей выживаемости проводился с использованием программного пакета Prism 3.0 (лиц. диск № G3-A10961-051). За точку отсчета принимали день начала лечения. Выбытие пациента из-под наблюдения и смерть от причины, не связанной с данным заболеванием, относили к цензурированным случаям.
Результаты и обсуждение.
Все больные, включенные в исследование, завершили лечение в соответствии с планом. Средняя продолжительность курса лечения составила 62 дня в первой группе и 68 — во второй. Ранние лучевые реакции слизистой варьировали от катарального до сливного мукозита, который наблюдался в единичных случаях, реакции кожи проявлялись в виде сухого эпидермита. Их количество и выраженность в обеих группах были практически одинаковыми. У всех больных лучевые реакции удавалось купировать в течение 2 нед применением стандартной терапии. В группе терморадиотерапии не было ни одного случая термического ожога.
Поздние лучевые изменения нормальных тканей в группе терморадиотерапии выявлены у 10 пациентов (21,7%), из них тяжелые, в виде фиброзно-дистрофических изменений кожи и мягких тканей III степени, — у 1 больного, остеорадионекроза нижней челюсти — у 2 больных, тризма — у 1 больного. В группе лучевой терапии частота поздних лучевых повреждений составила 16% (9 больных), изменения тяжелой степени развились у 3 больных. Различие между группами статистически недостоверно. Данные изменения у всех пациентов развились в течение первых 2 лет после окончания лечения.
Анализ непосредственных и отдаленных результатов лечения продемонстрировал преимущество метода терморадиотерапии. Полный клинический эффект через 4 нед после окончания лечения был достигнут у 29 больных (63%) в группе локальной гипертермии и у 30 (53,5%) — в группе лучевой терапии. Пятилетняя общая выживаемость в первой группе составила 40,18%, во второй — 17,8% (различия статистически достоверны, р=0,0426). Медиана выживаемости в первой группе — 9,4 мес, во второй — 18,1 мес. В группе терморадиотерапии 22 больных погибли от прогрессирования основного заболевания, 2 — от метастазов в легкие и средостение при отсутствии местного рецидива, 1 — от причин, не связанных со злокачественным новообразованием, 5 выбыли из-под наблюдения в различные сроки после окончания лечения. Сроки наблюдения составили от 6 до 68 мес.
В группе лучевой терапии 40 больных погибли от прогрессирования основного заболевания, 3 — от причин, не связанных со злокачественным новообразованием, 5 — в различные сроки выбыли из-под наблюдения. Сроки наблюдения составили от 6 до 67 мес.
Прогрессирование заболевания в большинстве случаев происходило в первые 2 года после окончания лечения.
Проведен анализ выживаемости больных в зависимости от локализации опухоли, распространенности первичного очага и степени поражения метастазами регионарных лимфатических узлов. Пятилетняя общая выживаемость пациентов с поражением лимфоузлов, соответствующим N1, составила 48,6% в первой и 26,8% — во второй группе (различие статистически недостоверно, р=0,0682), а медиана выживаемости — 18,8 и 10,3 мес (рис. 1). В случае N2 пятилетняя общая выживаемость составила 37,06% в группе терморадиотерапии и 7,52% — в группе лучевой терапии (р=0,0064, различие достоверно), медиана выживаемости — 18,3 и 8,3 мес соответственно (рис. 2).
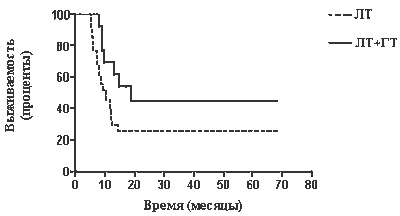 |
| Рис. 1. Выживаемость больных раком в стадии T2–3 N1 в зависимости от метода лечения: 1 — лучевая тера-
пия; 2 — терморадиотерапия |
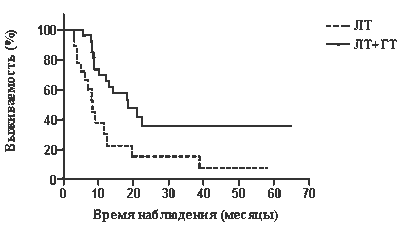 |
| Рис. 2. Выживаемость больных раком в стадии T2–3N2 в зависимости от метода лечения: 1 — лучевая тера-
пия; 2 — терморадиотерапия |
Анализ результатов лечения в каждой из групп в зависимости от локализации первичного очага (ротоглотка, гортаноглотка, гортань) показал отсутствие достоверных различий выживаемости (р>0,05 во всех случаях). Анализ выживаемости в зависимости от распространенности первичной опухоли не проводился, так как подавляющее большинство больных в обеих группах (48 — в первой и 44 — во второй) имели первичный очаг, соответствующий Т3.
Результаты нашего исследования показали несомненное преимущество методики терморадиотерапии по сравнению со стандартной лучевой терапией в лечении местно-распространенного рака ротоглотки, гортаноглотки и гортани. Необходимо заметить, что максимальный эффект гипертермии наблюдался у пациентов с наименее благоприятным прогнозом (увеличение 5-летней выживаемости с 7,52 до 37,06% в стадиях T2–3N2).
Представляет интерес сравнение результатов нашей работы с данными исследований, посвященных другим методам радиомодификации. В работе 9 приведены сведения о 15 больных раком гортани стадии Т2–4N1–2, леченных с использованием СВЧ– и УВЧ-гипертермии, однако их выживаемость анализировалась в общей группе вместе с больными без метастазов. Другие авторы 16 сообщают, что использование мультифракционирования с увеличением суммарно-очаговой дозы на 15—20% повысило 5-летнюю выживаемость с 13,1 до 58,4% при N1, c 7,1 до 21,3% при N2 по сравнению со стандартной лучевой терапией. При химиолучевом лечении в группах, где преобладали больные со стадиями T2–4N1–2, удавалось достичь повышения 5-летней выживаемости с 7,7 до 13,8—18,2% 17.
Заключение.
Сочетание локальной микроволновой гипертермии с облучением позволило, не увеличивая сроков лечения, а также частоты и выраженности лучевых реакций, улучшить выживаемости во всей группе пациентов. Представляется, что пути совершенствования результатов лечения данной группы больных лежат, во-первых, в применении химиолучевого лечения в сочетании с гипертермией (полирадиомодификация), а во-вторых, в расширении показаний к хирургическому лечению при наличии остаточной опухоли или метастазов после проведенного консервативного лечения.
Литература
Пачес А.И. Опухоли головы и шеи. М: Медицина; 2000; 480 с.
Лучевая терапия злокачественных опухолей. Под ред. Е.С.Киселевой. М: Медицина; 1996; 464 с.
Дарьялова С.Л., Бойко А.В., Черниченко А.В. Расширение показаний к радикальному лечению больных с запущенными опухолями за счет использования противоопухолевых препаратов в качестве модификаторов при лучевой терапии. В кн.: Тезисы докладов Пленума правления Всероссийского научного медицинского общества онкологов. Ростов-на-Дону; 1999; с. 196—198.
Jeremic B., Shibamoto Y., Stanislavlievic B. et al. Radiation therapy alone or with concurrent low-dose daily either cisplatin or carboplatin in locally advanced unresectable squamous cell carcinoma of the head and neck: a prospective randomized trial. Radiotherapy and Oncology 1997; 43: 29—37.
Dische S., Saunders M., Barret A. et al. A randomized multicentre trial of CHART versus conventional radiotherapy in head and neck cancer. Radiotherapy and Oncology 1997; 44: 123—136.
Baumann M., Bentzen M., K. Kian Ang. Hyperfractionated RT in head and neck cancer: a second look at the clinical data. Radiotherapy and Oncology 1998;46: 127—130.
Ярмоненко С.П., Вайнсон А.А., Конопляников А.Г. Клиническая радиобиология. М: Медицина; 1992; 296 с.
Datta N.R., Bose A.K., Kapoor H.K., Gupta S. Head and neck cancers: results of thermoradiotherapy versus radiotherapy. Int Jour of Hyperthermia 1990; 6: 479—486.
Мардынский Ю.С., Андреев В.Г., Лопатин В.Ф. Термолучевая терапия рака гортани. Вопросы онкологии 2000; 6: 708—711.
Кисличко А.Г., Бойко А.В. Лучевая терапия с локальной СВЧ-гипертермией местно-распространенного рака слизистой оболочки полости рта и ротоглотки. В кн.: Тезисы докладов Пленума правления Всероссийского научного медицинского общества онкологов. Ростов-на-Дону; 1999; с. 205—207.
Светицкий П.В., Пустовая И.В., Зубкова Т.В. и др. Лечение местно-распространенного рака органов полости рта и ротоглотки с дополнительным использованием СВЧ-гипертермии в условиях ингибирования кровотока. Российский онкологический журнал 2001; 2: 42—45.
Amichetti M., Romano M., Busana L. et al. Hyperfractionated radiation in combination with local hyperthermia in the treatment of advanced squamous cell carcinoma of the head and neck: a phase I—II study. Radiotherapy and Oncology 1997; 45: 155—158.
Wust P., Stahl H., Dieckmann K. et al. Local hyperthermia of N2/N3 cervical lymph node metastases: correlation of technical parameters and response. Int J Radiat Oncol Biol Phys 1996; 34: 635—646.
Valdagni R., Amichetti M. Report of long-term follow-up in a randomized trial comparing radiation therapy and radiation therapy plus hyperthermia to metastatic lymphnodes in stage IV head and neck patients. Int Jour Radiat Oncol Biol Phys 1993; 28: 163—169.
Ткачев С.И. Сочетанное применение лучевой терапии и локальной гипертермии в лечении местно-распространенных новообразований. Дис. … докт. мед. наук. М; 1995.
Гладилина И.А., Алиев Б.М., Голдобенко Г.В. Отдаленные результаты мультифракционированного облучения больных раком ротоглотки III—IV стадии заболевания. Вопросы онкологии 2000; 1: 44—49.
Карасева В.В., Кицманюк З.Д., Мусабаева Л.И. и др. Химиолучевое лечение больных местно-распространенным раком полости рта и ротоглотки. Российский онкологический журнал 2000; 4: 21—23.
|

