© Ю.Р. Ефременко, К.Н. Конторщикова, 2003 г.
УДК 577.156.1
Поступила 15.01.2003 г.
Ю.Р. Ефременко, К.Н. Конторщикова
Нижегородская государственная медицинская академия; ЦНИЛ, Нижний Новгород
Состояние системы протеолиза в условиях окислительных воздействий на организм
К числу фундаментальных достижений биологии последних двадцати лет относится признание протеолиза как особой формы физиологической регуляции. Регуляторная роль протеолитических ферментов осуществляется в протеолизе двух типов: полном и ограниченном. Полный протеолиз представляет собой деградацию белка, расщепление аномальных, мутировавших белковых структур [1—3]. В то же время ограниченный протеолиз считают универсальным механизмом, ответственным за образование, инактивацию и модификацию гормонов, ферментов, физиологически активных пептидов [4, 5]. Реакции ограниченного протеолиза лежат в основе функционирования таких важнейших физиологических систем, как ренин-ангиотензиновая (РАС), калликреин–кининовая (ККС), иммунитета, гемостаза, комплемента, апоптоза. Таким образом, протеолиз контролирует концентрацию основных биорегуляторов, от функционирования которых, по существу, зависит весь характер метаболизма.
На активность протеолитических ферментов воздействует много факторов. Среди них особого внимания заслуживают соединения с высоким окислительным потенциалом. К таковым относится озон, широко применяющийся в клинической практике. Влияя на окислительно-восстановительное состояние клетки, озон принимает участие и в регуляции внутриклеточных метаболических процессов. Кроме того, в условиях окислительного воздействия существует опасность чрезмерной активации системы протеолиза и свободно-радикальных процессов. В связи с этим перспективным представляется изучение состояния системы протеолиза в ответ на введение озона в составе физиологического раствора.
Цель исследования — оценить эффект воздействия озонированного физиологического раствора на состояние системы протеолиза.
Материалы и методы. Эксперименты проводились на 242 белых нелинейных крысах, самцах, массой 200—220 г. Животным вводили внутрибрюшинно 1 мл озонированного физиологического раствора. Биохимические анализы проводились с плазмой крови, гомогенатами тканей поджелудочной железы и тонкого кишечника.
Во всех исследуемых тканях определяли: активность трипсиноподобных и химотрипсиноподобных протеиназ, эластазы, лейцинаминопептидазы (ЛАП), калликреина и кининазы [6], активность основных ингибиторов протеолиза a1-антитрипсина и a2-макроглобулина [7], а также интенсивность индуцированной хемилюминесценции и уровень молекулярных продуктов перекисного окисления липидов (ПОЛ).
Результаты и обсуждение. Исследования показали, что введение озонированного физиологического раствора с невысокими дозами озона (0,027—0,505 мкг) оказывает положительный эффект на системы протеолиза и ПОЛ. Во-первых, потенциируя процессы пероксидации сразу после окислительного воздействия по типу реакций обратной связи, озон достоверно активирует антиоксидантное звено защиты организма животного. Во-вторых, отмеченное повышение активности основных ингибиторов протеолиза может свидетельствовать о включении компенсаторных механизмов, запускающих физиологические процессы адаптации.
При однократном введении дозы озона 0,027 мкг активность химотрипсиноподобных протеиназ в гомогенатах ткани кишечника не значительно, но достоверно повышалась, а в плазме и ткани поджелудочной железы изменения были недостоверны. Особое внимание вызывает эластаза: активность достоверно возрастала лишь в поджелудочной железе через 2 ч после окислительного воздействия, а затем резко снижалась и через 48 ч была на уровне интактной группы. В плазме и гомогенатах кишечника достоверного повышения активности этого деструктивного фермента не отмечалось.
Калликреин-кининовая система также реагировала на окислительное воздействие очень умеренно. Результаты свидетельствуют о том, что в плазме крови и кишечнике активность калликреина и кининазы не превышала таковую в интактной группе.
Особенностью ответной реакции системы протеолиза на введение разовой дозы озона 0,053 мкг явилось отсутствие в плазме крови через 48 ч после окислительного воздействия достоверных изменений активности всех исследуемых протеиназ.
В то же время более высокие дозы озона (1,104 – 5,995 мкг) вызывают разобщение в функционировании системы ПОЛ—АОА, с превалированием прооксидантных процессов. Одновременно выявлено значительное повышение протеолитической активности в исследуемых объектах, со снижением ингибиторного потенциала плазмы крови. По данным Л.Е. Бобыревой, избыточное образование свободных радикалов, накопление продуктов ПОЛ в ткани поджелудочной железы нарушает гидрофобные связи макромолекул, сосудистой стенки, а также островков Лангерганса [8]. Под действием АФК, белки b-клеток денатурируют и становятся антигенами для собственной иммунной системы. Повышенная чувствительность b-клеток к действию АФК обусловлена еще и тем, что в них снижена активность антиоксидантных защитных систем [9, 10]. Однако следует подчеркнуть, что повреждающее действие АФК реализуется разными путями. С одной стороны, АФК в высокой концентрации могут прямо повреждать клетки за счет активации ПОЛ, с другой — за счет повреждения клеток нарушать баланс в системе протеолиз – антипротеолиз.
В наших исследованиях при введении озонированного физиологического раствора с дозой озона 3,03 мкг отмечена активация трипсина в 9 раз по сравнению с данными интактной серии животных (р<0,001) (см. рисунок).
Активность трипсиноподобных протеиназ при введении дозы озона
3,03 мкг (нмоль/мл·мин);* — p<0,001 относительно интактной
серии. ПЖ — поджелудочная железа, КИШ — кишечник, ПЛ — плазма крови
|
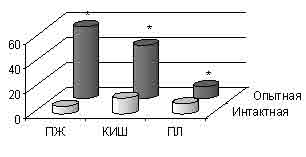 |
Трипсин, являясь активатором основных панкреатических ферментов, далее запускает весь каскад протеолитических энзимов.
Выявленная активация химотрипсиноподобных протеиназ в 1,6 раза (р<0,001) и эластазы — в 1,8 раза (р<0,001) подтверждает это.
Дальнейшее поступление панкреатических ферментов в кровь рассматривается как первичный фактор агрессии при развитии панкреатита. За этим следует активация (с участием все того же трипсина) ККС крови и тканей с выбросом значительного количества вторичных факторов агрессии – свободных кининов (прежде всего брадикинина), гистамина и серотонина. ККС является функциональным посредником между системами свертывания крови и фибринолиза, способна активировать систему комплемента и РАС. Известно, что калликреины играют роль медиаторов аллергических и воспалительных процессов, участвуют в регуляции микроциркуляции, артериального давления, коагуляции, активации системы комплемента, межклеточных взаимодействий, приводящих к возникновению морфологических изменений органов-мишеней.
При введении дозы озона 3,03 мкг протеолитическая активность основного фермента ККС — калликреина — в поджелудочной железе увеличивается в 4,6 раза (р<0,001), в плазме крови активация была менее выражена — в 1,4 раза (р<0,001).
В то же время отмеченное в плазме повышение активности кининдеградирующего фермента — кининазы — в 4,3 раза (р<0,001) свидетельствует о возможности физиологической регуляции состояния ККС при введении данной дозы озона. Выявленное увеличение протеолитической активности калликреина и одновременно кининазы свидетельствует о «пропорциональной» активации ККС, которая характеризуется сохранением биохимического равновесия в самой системе и может рассматриваться как компенсаторная реакция.
Связующий фермент между ККС и РАС — лейцинаминопептидаза — также активировалась в ткани поджелудочной железы в 2 раза по сравнению со значениями в интактной группе животных (р<0,001). ККС и РАС являются антагонистами в отношении регуляции водно-электролитного обмена, сосудистого тонуса, артериального давления. В связи с этим повышение активности ЛАП, последующая активация АПФ, а следовательно, и ангиотензина II, в свою очередь, могут привести к возрастанию уровня АФК, инактивации брадикинина, вазоконстрикции сосудов, и соответственно, к повышению артериального давления [11—13].
Учитывая сложность всех образующихся реакций, а также усиление окислительного воздействия, нельзя не остановиться на результатах, полученных при введении дозы озона 5,99 мкг. Ожидаемого дальнейшего повышения протеолитической активности в исследуемых тканях не наблюдалось. В гомогенатах тканей поджелудочной железы и тонкого кишечника активность изучаемых протеиназ оставалась либо на уровне интактных значений, либо незначительно повышалась. Наиболее ценная информация получена при изучении протеолитических ферментов в плазме крови. Выявлено достоверное повышение активности всех исследуемых протеолитических ферментов ( см. таблицу).
Изменения активности протеолитических ферментов на фоне введения озонированного
физиологического раствора (М±m) (доза введенного озона 5,99 мкг)
|
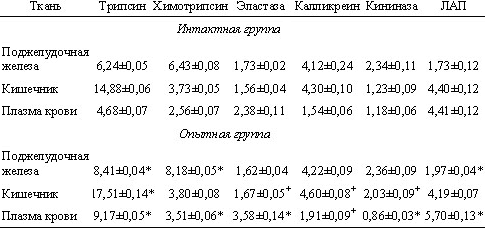 |
| * — достоверные различия относительно интактной серии (р<0,001); + — р<0,05. |
Следует отметить, что впервые зарегистрировано снижение активности кининазы в 1,4 раза (р<0,001) по сравнению с интактными показателями. Таким образом, наряду с активацией кининообразования развивается торможение процессов кининоразрушения. Это является дополнительным механизмом увеличения концентрации активных кининов в лимфе и крови.
Дальнейшие исследования показали снижение активности a1-антитрипсина и a2-макроглобулина в плазме крови, что может являться результатом действия нескольких причин. Во-первых, происходит интенсивное связывание этими ингибиторами протеиназ плазмы крови и тканей, резко активируемых после введения высоких доз озона. Во-вторых, протеолитические ферменты в активированном состоянии способны элиминировать комплексы протеиназа—ингибитор с последующим расщеплением молекулы белка. В-третьих, учитывая высокий уровень ПОЛ в исследуемых тканях, а также литературные сведения о повреждении свободными радикалами в первую очередь белковых молекул [14—17], можно утверждать, что происходит окисление активных центров ингибиторов (окислительная денатурация).
Заключение. Особенности ответной реакции системы протеолиза и ПОЛ на фоне введения озонированных растворов позволяют сделать вывод, что эффект зависит от общей дозы введенного озона. Введение невысоких доз озона приводит к образованию озонидов, которые выступают в роли «триггеров», запускающих процессы адаптации и индуцирующих биохимические и гемодинамические реакции, лежащие в основе естественных механизмов активации, компенсации и регенерации.
В целом проведенный анализ показал, что определение активности протеолитических ферментов необходимо использовать как высокочувствительный индикатор эффективности и безопасности применения озонированных растворов.
Литература
- Гомазков О.А. Современные тенденции в исследовании физиологически активных пептидов. Успехи соврем биологии 1996; 116(1): 60—68.
- Карпищенко А.И., Демидов А.Н., Тырененко В.В. и др. Метод определения конститутивной и индуцибельной форм белка теплового шока 70 кДа в миокарде и лимфоцитах человека. Клиническая лабораторная диагностика 2000; 3: 10—13.
- Кирковский В.В. Детоксикационная терапия при перитоните. Минск: Полифакт-Альфа; 1997; 190 с.
- Соловьева Н.И., Елисеева Ю.А., Локшина Л.А. Протеолитические ферменты и их биологические функции. Вестник РАМН 1995; 2: 3—9.
- Мареев В.Ю. Четверть века эры ингибиторов АПФ в кардиологии. Рус мед журнал 2000; 8: 15—16.
- Erlanger B. F., Kokowsky N., Cohen W. Proteinases activity in biological substrats. Arch biochem and biophys 1961; 95(2): 271—278.
- Карягина И.Ю., Зарембский Р.А., Балябина М.Д. Использование метода комплексного определения активности трипсиноподобных протеиназ, a1-антитрипсина и a2-макроглобулина в гастроэнтерологической клинике. Лабораторное дело 1990; 2: 10—13.
- Бобырева Л.Е. Свободно-радикальное окисление, антиоксиданты и диабетические ангиопатии. Проблемы эндокринологии 1996; 6: 14—19.
- Горелышева В.А., Смирнова О.В., Дедов И.И. Использование никотинамида при лечении инсулинзависимого сахарного диабета в дебюте заболевания. Пробл эндокринологии 1996; 46(6): 165—167.
- Nerup J. Enteropancreatic circulation of digestive enzymes. Diabetologia 1994; 37: 82—89.
- Доценко В.Л., Демидова Т.Ю., Нешкова Е.А. и др. О возможном участии АПФ и лейкоцитарной эластазы в патогенезе инсулиннезависимого сахарного диабета. Вопросы медицинской химиии 1999; 44(2): 14—17.
- Сергеева Т.В., Кобалава Ж.Д., Чистяков Д.А. Связь полиморфизма генов ренин-ангиотензиновой системы с гипертонической болезнью и инсулиннезависимым сахарным диабетом. Клин медицина 2000; 7: 9—15.
- Швецов М.Ю. Блокаторы рецепторов ангиотензина II – первый опыт и перспективы применения в нефрологии. Тер архив 2000; 6: 73—79.
- Арчаков А.И., Мохосев И.М. Модификация белков активным кислородом и их распад. Биохимия 1991; 54(2): 179—186.
- Желебенко Г.И., Васильев И.Т., Яровая Г.А., Муладзе Р.Б. Состояние калликреин-кининовой системы и уровень антипротеиназного потенциала при послеоперационном лечении различных форм перитонита. Вопросы мед химии 1995; 1: 49—53.
- Маянский Д.И., Урсов И.С. Лекции по клинической патологии. Новосибирск; 1997; 249 с.
- Cross C., Reznic A. Z., Packer L. et al. Oxidative damage to human plasma proteins by ozone. Free Radical Res Comms 1992; 15(6): 347—352.
|

