© А.А. Соломаха, 2003 г.
УДК 616.33—089:681.142.37
Поступила 28.02.2000 г.
А. А. Соломаха
Лаборатория нейросетевых технологий ПГПУ им. В.Г. Белинского, Пенза
Компьютерное прогнозирование ранних осложнений после операций на желудке
Важной проблемой хирургии органов брюшной полости остаются ранняя диагностика и лечение послеоперационных интраабдоминальных осложнений [1, 2]. В последние годы для объективизации диагноза используется множество дополнительных методов обследования: ультразвуковое и радиоизотопное сканирование, компьютерная томография, лапароскопия [3,4]. Однако они, играя несомненную роль в диагностике уже имеющихся осложнений, не могут дать информации для прогнозирования риска возникновения осложнений возможных [5, 6].
Очевидная актуальность вопросов профилактики интраабдоминальных осложнений требует разработки более эффективных математических методов прогнозирования течения послеоперационного периода и принятия рациональной трансфузионной тактики [7, 8].
Одним из современных методов исследования риска возникновения ранних послеоперационных осложнений является нейросетевое прогнозирование [2, 6, 9]. Преимущество нейрокомпьютерного моделирования заключается в способности синтеза решающих диагностических правил для прогнозирования осложнений в хирургии на основе обучающей выборки, составленной хирургами-экспертами абдоминального профиля по данным клинико-лабораторных показателей [9—11].
Цель исследования — оценка нейрокомпьютерного моделирования как метода прогнозирования риска возникновения ранних осложнений после операций на желудке.
Работа выполнена по данным Пензенского онкологического диспансера в Лаборатории нейросетевых технологий Пензенского государственного педагогического университета им. В.Г. Белинского, на основе опыта лечения 132 больных с ведущими заболеваниями: раком и язвенной болезнью желудка и двенадцатиперстной кишки. У всех больных проведен анализ результатов оперативных вмешательств. Длительность анамнеза составила от 4 мес до 2 лет. У 120 пациентов выполнялись операции по поводу рака, у 12 — в связи с язвенной болезнью. Были выполнены следующие оперативные вмешательства: гастрэктомия, субтотальная резекция желудка, а также резекции желудка по первому и второму способу Бильрота. У 112 пациентов гистологически верифицирована аденокарцинома различной степени дифференцировки, у 2 пациентов — скирр, у 1 — лимфома желудка, у 5 — солидный рак. У 10 пациентов гистологически верифицирована язвенная болезнь желудка, у 2 — хронические язвы двенадцатиперстной кишки. Стадийность онкологического заболевания была разной: I стадия — 12 пациентов (10%), II — 32 (27,5%), III — 61 (50,8%), IV — 17 (11,7%).
Необходимо подчеркнуть, что лучевое и химиотерапевтическое лечение у изучаемых больных не применялось. Лабораторные исследования, выполненные в онкологическом диспансере, являются унифицированными, так как проводились одними и теми же врачами. Операции произведены двумя основными бригадами хирургов, имеющих высшую и первую квалификационные категории.
Среди пациентов было 43 женщины и 89 мужчин в возрасте от 23 до 80 лет (табл. 1).
Таблица 1
Распределение больных по полу и возрасту
|
 |
Средний возраст мужчин составлял 70,6 года, женщин — 64,2 года.
Сопутствующая патология отмечалась у 125 пациентов: атеросклероз — 121, артериальная гипертензия — 11, сахарный диабет — 4, хронический диффузный бронхит с легочно-сердечной недостаточностью — 40, остаточные нарушения мозгового кровообращения — 3, тиреотоксический зоб — 1, неактивный туберкулез легких — 1, хронический гепатит — 1, хронический панкреатит — 2, хронический калькулезный холецистит — 1, ревматоидный полиартрит — 2, хронический пиелонефрит — 1, мочекаменная болезнь — 1, ожирение — 2, кистома яичников — 1, хронический отит — 1, доброкачественная гиперплазия предстательной железы — 2, нейрофиброматоз — 1, глаукома — 1. Кроме того, одна больная страдала системной склеродермией.
В структуре послеоперационных осложнений нами выделены 4 группы, имеющие разный патогенетический механизм: I — гнойно-септические, II — кишечная непроходимость, III — кровотечения, IV — сердечно-легочные осложнения. Гнойно-воспалительные осложнения представлены в табл. 2.
Таблица 2
Характер послеоперационных осложнений
|
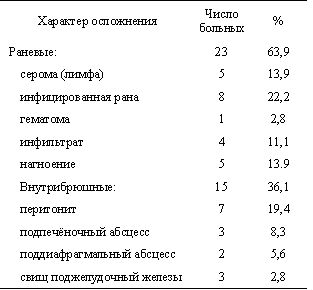 |
Термин «инфицированная рана» взят нами неслучайно, а в соответствии с наблюдаемыми клиническими ситуациями у оперированных больных в раннем послеоперационном периоде. В.Г. Гаршиным еще в 1939 г. установлен синхронизированный процесс эпителизации раны и созревания грануляционной ткани (цит. по: БМЭ. Т. 5; 1977; с. 31). Это относится и к операционным ранам. В норме заживление чистой раны осуществляется за две недели (цит. по: БМЭ. Т. 21; 1983; с. 524). В инфицированной ране, в отличие от гнойной, нагноение является осложнением, а не закономерным компонентом раневого процесса (цит. по: БМЭ. Т. 21; 1983; с. 526).
Нейросетевое прогнозирование осуществлялось с применением персонального компьютера [9]. Изучение проводилось на основе 19 клинико-лабораторных показателей:
возраст;
сопутствующая патология;
длительность операции;
стадия онкопроцесса;
объем операции;
гемоглобин;
эритроциты;
лейкоциты;
скорость оседания эритроцитов;
остаточный азот;
сахар крови;
общий билирубин;
мочевина;
общий белок;
фибриноген;
протромбиновый индекс;
белок в моче;
изменения электрокардиограммы;
изменения спирограммы.
Лабораторные данные анализировались за 5—10 дней до предстоящей операции.
Неоспоримым фактором в клинической хирургии является прямая пропорциональность развития гнойных послеоперационных осложнений от объема резецируемых органов. При проведении нейросетевого анализа, пришлось столкнуться с проблемой интерпретации разных по объему оперативных вмешательств и их последующего влияния на послеоперационный исход. Для решения возникшей проблемы было выполнено кодирование объема операций (табл. 3).
Таблица 3
Кодирование выполненной операции
|
 |
Следует оговориться, что примерно равноценны по тяжести и объему выполненной операции следующие вмешательства: резекция 2/3 желудка, лимфаденэктомия, удаление капсулы поджелудочной железы, поэтому им присвоено цифровое обозначение — 3. Известно также, что как самостоятельная операция лимфаденэктомия или удаление капсулы поджелудочной железы не применяются, но нередко сопровождают комбинированные операции. В случае выполнения комбинированной операции значение кода одного оперативного вмешательства умножается на код другой операции.
Проводилось также кодирование данных ЭКГ и спирограммы с целью объективного исследования и изучения их роли на исход оперативного вмешательства. Все пациенты были оперированы в плановом порядке, и у них в течение года до операции не было инфаркта миокарда. Наличие изменений на ЭКГ кодировалось цифрой 1, а их отсутствие — 0. К изменениям на ЭКГ отнесены: рубцовые изменения миокарда, постоянная форма аритмии, признаки хронической гипоксической коронарной недостаточности. Наличие изменений спирограммы обозначалось цифрой 1, а их отсутствие — 0. К изменениям спирограммы отнесена дыхательная недостаточность обструктивного, рестриктивного, смешанного типа I, II степени. Необходимо отметить, что пациенты, имеющие III степень дыхательной недостаточности, были отнесены к группе высокого риска, поэтому плановое оперативное лечение проводилось им после ликвидации декомпенсации дыхательной недостаточности. Наличие сопутствующей патологии кодировано цифрой 1, а ее отсутствие — 0. Лабораторные показатели, а также возраст выражены в цифровом обозначении, поэтому использовались в исследовании без применения кодирования.
Пациентам изучаемой группы проводилось внутривенное переливание физиологического раствора, гемодеза, реополиглюкина, полиглюкина, неокомпенсана, при абсолютных показаниях — эритроцитной массы, плазмы. Это способствовало улучшению динамики клинико-лабораторных показателей. Прогнозируемый риск возникновения осложнений раннего послеоперационного периода составил 87%. Комплексная трансфузионная терапия позволила снизить риск возникновения ранних послеоперационных осложнений и предотвратить их появление в 12% случаев. Развитие различных осложнений отмечалось в 75% клинических наблюдений.
Анализируя ценность различных показателей в исследовании, целесообразно отметить, что в прогнозные модели не вошли такие лабораторные и клинические данные, как длительность операции, объем резецируемых органов, гемоглобин, эритроциты, мочевина, а также данные спирограммы. Например, такие клинические и лабораторные показатели, как возраст и лейкоциты, травматизм и наличие белка в моче не обладают разделительной силой, так как их значения одинаковы для всех случаев выборки. Наиболее информативными оказались три фактора: остаточный азот, общий белок, протромбиновый индекс; они обеспечивали наибольшее число вариантов моделей. Заметим, что при большом количестве вариантов достигается более высокая достоверность прогноза.
Проанализировав значимость и роль в прогнозировании ранних гнойных послеоперационных осложнений 19 клинико-лабораторных показателей, мы пришли к выводу, что нейросетевое прогнозирование отдает предпочтение двум основным трехфакторным моделям: первая модель описана выше — остаточный азот, общий белок, протромбиновый индекс. Вторая модель — наличие сопутствующей патологии, сахар крови и общий билирубин.
Объем и длительность оперативного вмешательства незначительно увеличивают риск возникновения ранних гнойных послеоперационных осложнений, в связи с этим они не являются основными при установлении прогноза. Таким образом, нейросетевое прогнозирование позволяет сократить объем необходимых клинико-лабораторных показателей, выявляемых в дооперационном периоде, более чем в 2 раза — с 19 до 7.
Нейросетевое прогнозирование является доступным диагностическим методом в любом рядовом лечебном учреждении. Данный метод неинвазивен и может служить основным у пациентов пожилого и старческого возраста.
Литература
- Временная и стойкая утрата трудоспособности у хирургических больных. Под ред. проф. Р.Т. Скляренко, доц. В.С. Павлова. СПб; 1998; 304 с.
- Пиксин И.Н., Соломаха А.А. Нейросетевое прогнозирование ранних послеоперационных осложнений в абдоминальной хирургии. Вестн Мордовского гос университета им. Н.П. Огарева 1997; 2-3: 112—115.
- Панцирев Ю.М., Гаспарян С.А., Зарубина Т.В. и др. Прогноз и ежедневная оценка динамики состояния больных с перитонитом. Хирургия 1993; 10: 16—19.
- Товаченков В.И. Лечение острого деструктивного панкреатита. Автореф. дис. … канд. мед. наук. Воронеж; 1998.
- Филиппов С.И. Современные технологии в комплексном лечении перитонита. Автореф. дис. … докт. мед. наук. Омск; 1997.
- Шевченко Ю.Л., Шихвирдиев Н.Н., Оточкин А.В. Прогнозирование в кардиохирургии. СПб: Питер; 1998; 208 с.
- Алипов В.В. Оптимизация прогноза в неотложной хирургии новообразований желудочно-кишечного тракта. Автореф. дис. … докт. мед. наук. Саратов; 1997.
- Берсанов Х.-А.У. Прогнозирование, диагностика и лечение послеоперационных осложнений с применением низкоинтенсивного лазерного излучения. Автореф. дис. … канд. мед. наук. М; 1997.
- Щетинин В.Г., Соломаха А.А. Применение компьютерных «нейронных сетей» в клинической лабораторной диагностике. Клин лаб диагностика 1998; 10: 21—33.
- Нейрокомпьютеры и интеллектуальные роботы. Под ред. Н.М. Амосова. Киев: Наукова думка; 1991; 272 с.
- Россиев Д.А., Ананьев И.Н. Нейросетевая дифференциальная диагностика на основе субъективных данных. В кн.: Нейроинформатика и ее приложения. Красноярск; 1995; с. 52.
|

