© А.Р. Кокобелян, 2003 г.
УДК 617.586—089
Поступила 26.05.2003 г.
А.Р. Кокобелян
Государственная медицинская академия, Нижний Новгород.
Лечение синдрома «диабетической стопы» в зависимости от формы поражения
Сахарным диабетом в настоящее время страдает 4—6% населения развитых стран [1]. В хирургических стационарах резко возросло число больных с синдромом «диабетической стопы» (СДС), который встречается у 28,6—65% больных сахарным диабетом в возрасте от 25 до 75 лет [2, 3].
СДС, являясь поздним осложнением сахарного диабета, представляет собой сложный симптомокомплекс нарушений нейрососудистых, костных, мягкотканных компонентов стопы и проявляется макро– и микроангиопатией, нейропатией, остеоартропатией с развитием трофических нарушений в тканях стопы [4—6]. Изменения в мелких сосудах (микроангиопатия) носят специфический для сахарного диабета характер: утолщение базальной мембраны капилляров, пролиферация эндотелия и отложение в стенке артерий гликолипопротеидов. Поражение крупных сосудов (макроангиопатия) расценивается как ранний и распространенный атеросклероз.
В «диабетической стопе» обнаруживаются бактериальные и грибковые инфекции. Чаще всего их вызывают ассоциации микроорганизмов: стафилококки, стрептококки, энтерококки, анаэробная неклостридиальная инфекция и др. Особое место в раневой инфекции у больных сахарным диабетом занимает эпидермальный стафилококк, являющийся наиболее частым возбудителем хирургической неспецифической инфекции у ослабленных больных с СДС [7].
На сегодняшний день ВОЗ (1991) выделяет нейропатическую, ишемическую и смешанную форму СДС. Однако, поскольку в патогенезе диабетической остеоартропатии наряду с дистальной нейропатией участвуют метаболический и сосудистый факторы, ряд авторов выделяют ее в отдельную форму [8].
Цель исследования — определить наиболее оптимальную схему комплексного лечения СДС в зависимости от формы поражения с коррекцией местных и общих нарушений в организме, предусматривающего не только удаление пораженных тканей, но и сохранение опорной функции нижних конечностей. Материалы и методы. В клинике общей хирургии НГМА им. А.И.Кожевникова с 1997 г. лечилось 196 больных сахарным диабетом, осложненным СДС в возрасте от 24 до 89 лет. Среди них 82 мужчины (41,8%) и 114 женщин (58,2%). У 52 человек (26,5%) наблюдался сахарный диабет 1-го типа, у 73,5% — 2-го типа (табл. 1). Длительность заболевания свыше 10 лет была у 82,2% обследованных. Таким образом, мы в основном имели дело с отчетливыми проявлениями диабетической ангиопатии.
Средний возраст больных сахарным диабетом 1-го типа составил — 31,4 года, 2-го типа — 67,8 года. Большинство больных (38,8%) — это пожилые пациенты в возрасте от 60 до 70 лет.
Таблица 1
Распределение больных по полу и возрасту (мужчины/женщины) |
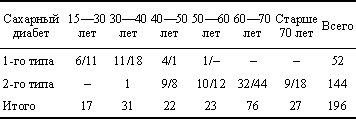 |
Таблица 2
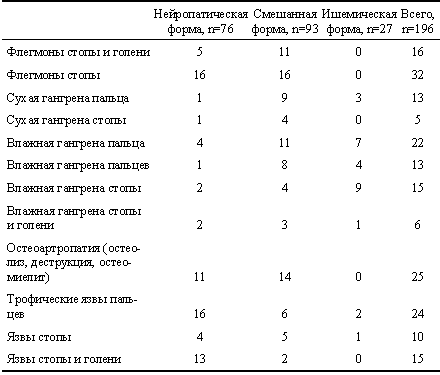
Проявления СДС при различных его формах |
 |
Декомпенсированный диабет тяжелой формы отмечен у 171 больного (87,2%), средней тяжести — у 24, у 1 больной — легкого течения. Инсулинпотребный сахарный диабет 2-го типа был у 105 больных (53,5%). 39 человек из этой группы принимали пероральные сахароснижающие препараты или обходились соблюдением диеты (стол №9), из них 31 человек нарушали режим: не всегда соблюдали диету и не постоянно принимали таблетированные препараты. Такие больные поступали на лечение с гангреной стопы, и им выполнялась срочная высокая ампутация.
В наших наблюдениях превалировали больные со смешанной формой СДС — 93 человека (47,4%), с нейропатической формой было 76 и с ишемической формой — 27 (табл. 2). У всех больных уровень глюкозы в крови при поступлении превышал 10,0 ммоль/л и имелись по несколько сопутствующих заболеваний (ишемическая болезнь сердца — у 153 больных, в том числе инфаркт миокарда в прошлом — у 21, гипертоническая болезнь — у 127, проявления хронической почечной недостаточности — у 98, пневмонии и бронхиты — у 38, острое нарушение мозгового кровообращения или его последствия — у 22, дисциркуляторная энцефалопатия — у 89, начальные проявления недостаточности мозгового кровообращения — у 43, анемия — у 83, ожирение — у 57, гепатит В или С — у 7, прочие — у 21 больного). Поэтому лечебно-диагностические мероприятия проводили в сотрудничестве с эндокринологом, кардиологом, офтальмологом и неврологом.
Всем больным с первого дня пребывания в клинике вводился простой инсулин 4 раза в сутки дробными дозами под контролем суточного уровня сахара крови.
Возникновение язвенно-некротического процесса на стопе в течение последних 2 мес до момента поступления отмечено у 46 больных (23,4%) и у 150 (76,6%) трофические нарушения возникли более 2 мес назад до поступления в клинику. Ранее лечение проводилось в центральных районных или городских больницах без положительного эффекта
Для оценки состояния кровообращения в нижних конечностях использовались клинические данные (наличие и характер пульсации магистральных сосудов, цвет кожных покровов и их температура) и данные инструментальных методов исследования (УЗДГ, ангиография, в том числе и через катетер, дуплексная скано-сонография). При УЗДГ и ангиографии устанавливали тип кровотока, наличие и уровень стенозов и окклюзий артерий. При дуплексном сканировании выявляли не только характер кровотока, но и точное месторасположение атеросклеротических бляшек, их размеры, степень сужения артерий, ригидность стенок артерий нижних конечностей, распространенность поражения, а при диабетической микроангиопатии обнаруживали утолщение и повышение эхогенности стенки дистальных артерий в связи с кальцинозом, выраженное диффузное утолщение комплекса интима—медиа с полной утратой дифференцировки на слои. Особенностями атеросклероза при диабете является относительно редкое поражение крупных сосудов и частое поражение артерий мелкого и среднего калибра и артериол. Наиболее часто атеросклеротическое поражение наблюдалось в подколенной, берцовых артериях и артериях стопы (склероз Менкеберга).
Для выявления диабетической остеоартропатии больным выполнялась рентгенография стопы в двух проекциях. Рентгенологическими признаками диабетического поражения стоп явились остеопороз (у 100%), остеолиз (у 57%), деструкция (у 50%), кальциноз артерий стопы в виде «кольца» (у 30%), фрагментарный кальциноз (у 13,3%), тотальный кальциноз с переходом на голень (у 16,7%).
С раневой поверхности производили забор отделяемого и направляли на посев для определения флоры и чувствительности к антибиотикам. Часто встречались ассоциации микроорганизмов (анаэробно-аэробные), видовой состав в процессе лечения изменялся неоднократно с преобладанием наличия в ране эпидермального стафилококка.
Следует подчеркнуть высокую частоту выделения Pseudomonas aeruginosa из ран как при поступлении, так и в процессе лечения, что обусловлено присоединением данного возбудителя, который зачастую является «госпитальным» штаммом.
У 7 больных проводилось исследование крови на продукты перекисного окисления липидов и на функциональную активность нейтрофилов (НСТ-тест) не только в системном, но и в регионарном кровотоке, где было выявлено повышение активности процессов пероксидации. Лечение и его результаты. Лечение больных с гнойно-некротическими поражениями нижних конечностей при сахарном диабете представляет очень трудную задачу, и даже при использовании всех современных методов лечения у 25—50% больных приходится прибегать к высоким ампутациям, чаще на уровне бедра [9]. В нашей стране каждые 5 из 6 нетравматических ампутаций выполняются больным с СДС, что составляет около 15 тысяч высоких ампутаций в год [10], а частота повторных ампутаций в течение 5 лет достигает 14—49% [11]. При выполнении экономных ампутаций, некрэктомий или вскрытий гнойников летальность снижается до 3,2—7,0%, а средняя продолжительность пребывания в стационаре до 34,6 койко-дня [12].
Плохие результаты лечения больных с СДС обусловлены несколькими причинами:
1) нарушением тканевого кровообращения за счет поражения мелких сосудов, к которым нередко присоединяются окклюзии магистральных сосудов атеросклеротического генеза [1];
2) усугублением гнойной инфекцией уже имеющихся глубоких нарушений всех видов обмена в организме, ведущих к развитию ацидоза, гипоксии и метаболической интоксикации [13];
3) снижением иммунитета, о чем свидетельствуют лимфопения, дисбаланс субпопуляций Т-лимфоцитов, накопление в крови иммунных комплексов, угнетение фагоцитарной активности нейтрофилов и макрофагов [14];
4) наличием ассоциации анаэробно-аэробной микрофлоры в очагах гнойного воспаления, что затрудняет проведение антибактериальной терапии [1];
5) феноменом взаимного отягощения всех видов обмена.
Используемая нами тактика лечения зависела от характера местных поражений тканей, состояния кровообращения в нижних конечностях и была направлена на сохранение анатомической структуры конечности и восстановление ее опорной функции.
У 76 больных с гнойно-некротическими изменениями и сохранением магистрального кровотока на стопе применялось консервативное лечение, направленное на коррекцию уровня сахара крови (диетотерапия, использование инсулина дробными дозами), борьбу с инфекцией (парентеральное применение антибиотиков широкого спектра действия). Если же у больного имелся влажный язвенно-некротический дефект, не дожидаясь результатов посева, лечение начинали с антибиотиков широкого спектра действия — комбинацией цефазолина, линкомицина и метрагила. Использовали препараты, улучшающие микроциркуляцию (реополиглюкин). Консервативная терапия дополнялась поэтапной некрэктомией, перевязками с протеолитическими ферментами, гипертоническим 10% раствором хлористого натрия, мазью «Левомеколь». После очищения раны и появления в ней ярких грануляций переходили на перевязки с куриозином. При наличии гангрены пальцев или свищевой формы остеоартропатии фаланг или плюснефаланговых суставов на фоне консервативного лечения выполняли ампутацию пальцев с резекцией головок плюсневых костей с обязательным удалением сухожилий как можно проксимальнее. Рана зашивалась наглухо с оставлением марлевого или резинового выпускника.
При флегмонах стопы и голени выполняли срочное вскрытие гнойников и затеков с последующими неокклюзивными перевязками. Разгрузка поврежденной конечности с помощью костылей проводилась до полного очищения ран от некрозов.
В комплексном лечении СДС широко применяли внутриартериальную инфузионную терапию (ВАИТ) [15]. Катетеризацию глубокой артерии, огибающей подвздошную кость, с последующей длительной внутриартериальной инфузионной терапией по описанной нами методике [16,17] у больных с сохраненной пульсацией на артериях стопы выполняли только при обширных гнилостных флегмонах в день поступления больного или на следующий день после вскрытия гнойников (8 человек), а также при прогрессировании гнойно-некротических изменений в процессе стандартного лечения. В состав инфузата входили: реополиглюкин — 400 мл, трентал — 5 мл, папаверин — 2 мл, линкомицин — 600 мг и обязательно гепарин — 15—20 тыс. ед. Внутрисосудистое введение этих препаратов не имело осложнений.
Выполнено 31 ампутация пальцев стопы, 32 вскрытия гнойников, всем выполняли поэтапные некрэктомии. 13 больных пролечили без оперативного вмешательства (больные с трофическими язвами).
У больных этой группы (с сохраненным магистральным кровотоком) удалось ликвидировать гнойно-некротические изменения стопы и сохранить конечность.
Иная лечебная тактика применялась у 120 больных с гнойно-некротическими поражениями стоп при отсутствии кровотока хотя бы в одной из артерий стопы. Только консервативная терапия в сочетании с перевязками у большинства этих больных была бы обречена на неудачу. Поэтому она дополнялась ВАИТ (при условии наличия пульсации на подколенной артерии), на фоне которой выполняли ампутации в пределах тканей стопы. В этом случае в инфузат дополнительно вводили витамины, гормональные препараты, мощные антибиотики, антигипоксанты и антиоксиданты, вазапростан, сулодексид и др. Выполнено 36 катетеризаций артерий. При невозможности осуществлять внутриартериальные инфузии проводилась системная интенсивная антибактериальная терапия внутривенно и внутримышечно.
У больных на фоне внутриартериальных инфузий наблюдалось улучшение общего состояния, купирование болевого синдрома. В течение первых 3 сут от начала инфузий убывал или полностью исчезал гипостатический отек пораженной конечности. К середине второй недели терапии удавалось уменьшить или ликвидировать воспалительные явления вокруг ран, устранить лимфаденит и лимфангиит, отторгались некрозы и появлялись грануляции. ВАИТ продолжалась в среднем 40—45 дней.
У 6 больных с окклюзией артерий голени ВАИТ не принесла эффекта в течение первых 10—14 дней: у них нарастала интоксикация, прогрессировали гнойно-некротические процессы на стопе, поэтому им произвели ампутации на уровне голени. Они выполнялись на фоне внутриартериальных инфузий, которые продолжались до полного заживления раны, при этом создавались благоприятные условия для заживления раны первичным натяжением.
У одного больного было выполнено бедренно-подколенное шунтирование при окклюзии бедренно-подколенного сегмента. ВАИТ при этом предпринималась в качестве предоперационной подготовки к реконструктивной операции и в послеоперационном периоде — до полного заживления ран.
Пяти больным произведена поясничная симпатэктомия, при этом положительный эффект наблюдался только у одного пациента.
При отсутствии пульсации на подколенной артерии, но при наличии хорошо проходимой глубокой артерии бедра ВАИТ использовали с целью снижения уровня ампутации с сохранением коленного сустава для последующего протезирования.
С целью ликвидации местной и общей гипоксии, коррекции нарушений метаболизма, микроциркуляции, влияния на инфекционный процесс (особенно на анаэробы), активации лейкоцитарного механизма разрушения бактерий, повышения чувствительности микрофлоры к антибиотикам, стимуляции репаративных процессов больным применяли гипербарическую оксигенацию.
Ампутаций бедра было выполнено 13, голени — 24 (18,9% высоких ампутаций), стопы — 3, пальцев — 66, одной больной пришлось выполнить реампутацию голени; вскрытий гнойников — 18. Результаты операций хорошие.
Умерло 11 больных, из них 2 от острого нарушения мозгового кровообращения, 2 — от острого инфаркта миокарда, 4 — от почечной недостаточности, 2 — от полиорганной недостаточности; у одного больного заболевание осложнилось висцеральной формой геморрагического васкулита (диабетическая энтеропатия) и смерть наступила от профузного кишечного кровотечения. Заключение. Результаты проделанной работы позволяют сделать следующие выводы:
1. Лечение СДС должно быть комплексным, включать оперативное лечение, направленное на ликвидацию гнойно-некротического очага и восстановление кровотока, инсулинотерапию, лечение инфекции (интенсивная непрерывная антибиотикотерапия), улучшение микроциркуляции, гипербарическую оксигенацию, ВАИТ, полную разгрузку стопы, местную обработку раны, лечение сопутствующей патологии, инструктирование больного и его родственников.
2. Лечение должно зависеть от формы СДС. При сохранении магистрального кровотока проводятся оперативное лечение (вскрытие гнойников, по возможности малые ампутации, местное лечение трофических язв), инсулинотерапия, антибиотикотерапия, гипербарическая оксигенотерапия, введение препаратов, улучшающих микроциркуляцию; полная разгрузка стопы. ВАИТ применяется только при обширных гнилостных флегмонах стопы и голени.
3. При отсутствии пульса на одной из артерий стопы проводится более интенсивная терапия с применением малых ампутаций с целью сохранения максимальной длины стопы на фоне ВАИТ.
4. При неэффективности ВАИТ в течение 7—12 дней и при прогрессировании гнойно-некротического процесса на стопе целесообразно выполнять высокую ампутацию нижней конечности.
5. Реконструктивные операции на сосудах зачастую невыполнимы, так как при сахарном диабете поражается дистальное артериальное русло, а при отсутствии надежных путей оттока крови в голени и стопе и безупречной проходимости микрососудов эти операции обречены на неудачу.
Литература
- Осложнения сахарного диабета (клиника, диагностика, лечение, профилактика). Под ред. И.И.Дедова. М;1995; 42 с.
- Батрашов В.А., Сидоров А.К. Частота возникновения облитерирующего атеросклероза нижних конечностей у больных сахарным диабетом 1 и 2 типа. В кн.: Современные аспекты диагностики, лечения, профилактики поражений нижних конечностей у больных сахарным диабетом. Труды научно-практической конференции. М.; 1996; с. 38—41.
- Ратнер Г.Л., Серафимович Н.Н., Рудуш В.Э. Принципы лечения больных с диабетической ангиопатией нижних конечностей. М.;1989.
- Брискин Б.С., Сакунова Т.И., Якобишвили Я.И. Роль препарата мидокалм в комплексном лечении больных с синдромом «диабетической стопы», нейропатическая форма поражения. Хирургия 2000; 5: 52—55.
- Брискин Б.С., Тартаковский Е.А., Гвоздев Н.А. и др. Лечение осложненных форм синдрома диабетической стопы в условиях специализированного хирургического отделения. Хирургия 1999; 10: 53—56.
- Тартаковский Е.А., Якобишвили Я.И., Магомедов С.Н. Поясничная симпатэктомия в комплексном лечении больных с синдромом «диабетическая стопа». Врач 1998; 7: 33—35.
- Пальцын А.А., Колокольчикова Е.Г., Земляной А.Б., Светухин А.М. и др. Возбудители хирургической инфекции при поражениях нижних конечностей у больных сахарным диабетом. Анналы хирургии 2000; 5: 52—55.
- Богданович В.Л. Сахарный диабет. Н.Новгород: Изд-во НГМА; 1997.
- Бесман Б.М., Галенко-Ярошевский П.А., Мехта С.К., Тралдафиров К.В. Предотвращение ампутаций конечности у больных с осложнением «диабетической стопы». Хирургия 1999; 10: 49—52.
- Светухин А.М., Проскудина М.К. Комплексное хирургическое лечение больных с синдромом диабетической стопы. Хирургия 1998; 10: 64—66.

